AH
Ai H
08 Agustus 2022 05:34
Iklan
AH
Ai H
08 Agustus 2022 05:34
Pertanyaan
Pembuatan CaCl2 dilakukan dengan cara memanaskan Ca dan Cl2 sesuai reaksi : Ca + Cl2 → CaCl2. Jika terdapat 10 gram Ca dan 7,1 gram Cl2, berapakah Ca yang tersisa setelah bereaksi? (Ar Ca = 40, Cl = 35,5)
2
1
Iklan
AA
A. Anania
Mahasiswa/Alumni Hanyang University
26 Agustus 2022 08:07
Jawaban terverifikasi
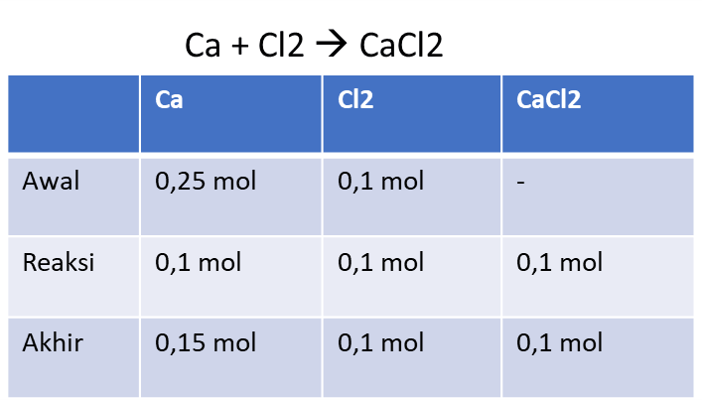
Jawabannya adalah 6 gram. Perhitungan banyaknya reaktan yang bereaksi atau produk yang dihasilkan setelah reaksi dapat dilakukan dengan menggunakan rumus perbandingan mol. Dalam suatu reaksi, perhitungan mol pereaksi atau produk mengikuti perbandingan dari koefisien pereaksi yang habis bereaksi. Pada reaksi diatas, Ca + Cl2 → CaCl2. Diketahui jumlah Ca sebanyak 10 gram, sehingga perhitungan molnya adalah: Mol Ca = massa / Mr Mol Ca = 10 gram / 40 g/mol Mol Ca = 0,25 mol Sedangkan Cl2 terdapat sebanyak 7,1 gram, sehingga perhitungan molnya adalah: Mol Cl2 = massa / Mr Mol Ca = 7,1 gram / (2x35,5) g/mol Mol Ca = 7,1 gram / 71 g/mol Mol Ca = 0,1 mol Perhitungan mol reaksi diatas adalah mengikuti tabel dibawah ini: Dari tabel diatas, diketahui bahwa Cl2 habis bereaksi, sedangkan Ca yang tersisa adalah sebanyak 0,15 mol. Maka massa Ca yang tersisa adalah: Massa Ca sisa = mol x Mr Massa Ca sisa = 0,15 mol x 40 g/mol Massa Ca sisa = 6 gram Jadi, Ca yang tersisa setelah bereaksi adalah 6 gram.
· 5.0 (1)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



