AC
Annisa C
15 Januari 2022 17:44
Iklan
AC
Annisa C
15 Januari 2022 17:44
Pertanyaan
Pada 440°C, harga K untuk kesetimbangan: H2(g) + I2(g) ⇌ 2HI(g) adalah 49. Jika 1,0 mol gas H2; 1,0 mol gas I2;1,0 mol gas HI dimasukkan ke dalam suatu tempat tertutup yang bervolume 1 liter, berapa konsentrasi masing-masing gas pada saat kesetimbangan?
11
1
Iklan
DA
D. Aprilia
Mahasiswa/Alumni Universitas Pendidikan Indonesia
26 Januari 2022 03:07
Jawaban terverifikasi
Hai, Annisa :) Jadi, pada saat setimbang konsentrasi H2 dan I2 = 0,333 M, sedangkan konsentrasi HI = 2,334 M. Yuk simak pembahasannya berikut ini! Untuk menentukan konsentrasi setiap zat, pertama, kita tentukan dahulu nilai kuosien reaksi, Qc, untuk mengetahui apakah sistem telah setimbang atau belum, dan ke arah mana reaksi berlangsung jika belum setimbang. (perhatikan gambar ke-1) Karena Qc (1) < Kc (49), reaksi akan berlangsung dari arah kiri ke kanan hingga mencapai kesetimbangan. Jadi, konsentrasi H2 dan I2 akan berkurang dan konsentrasi HI akan bertambah sampai reaksi setimbang. Selanjutnya, asumsikan bahwa konsentrasi H2 berkurang sebanyak x hingga reaksi setimbang, lalu kita buat persamaan stoikiometri dengan tabel MRS (Mula-mula, Reaksi, Setimbang). Perhatikan gambar ke-2. Pada soal diketahui harga K (tetapan kesetimbangan) = 49 dan Volume nya 1 L. Oleh sebab itu, konsentrasi (Molaritas) setiap zat akan sama dengan mol nya (karena Molaritas = mol / Volume). [HI] = (1+2x) M [H₂] = (1-x) M [I₂] = (1-x) M Menurut hukum kesetimbangan, reaksi H2(g) + I2(g) ⇌ 2HI(g) dapat dinyatakan sebagai, K = [HI]² / [H₂] × [I₂] dimana K adalah tetapan kesetimbangan [HI], [H₂], [I₂] adalah konsentrasi masing-masing zat karena harga K sudah diketahui, maka, K = [HI]² / [H₂] × [I₂] 49 = [1+2x]² / [1-x] × [1-x] 49 = (1 + 4x + 4x²) / (1 – 2x + x²) 49 – 98 x + 49x² = 1 + 4x + 4x² 49 – 98 x + 49x² − 1 − 4x − 4x² = 0 45x² – 102x + 48 = 0 (berdasarkan rumus matematika, a = 45, b = −102, c = 48) dengan menggunakan rumus abc, didapatkan: (perhatikan gambar ke-3) x1 = 1,6 tidak mungkin karena melebihi mol mula-mula H2 dan I2, maka yang digunakan adalah x2 = 0,667. Jadi, pada kesetimbangan kimia tersebut, konsentrasi masing-masing spesi yaitu: [H2] = (1 – x) M [H2] = ( 1 – 0,667) M [H2] = 0,333 M [I2] = [H2] = 0,333 M [HI] = (1 + 2x) M [HI] = (1 + (2×0,667)) M [HI] = (1 + 1,334) M [HI] = 2,334 M
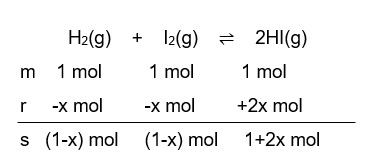
· 3.7 (3)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



