Dalton D
13 Januari 2023 10:06
Iklan
Dalton D
13 Januari 2023 10:06
Pertanyaan
Nomor gambar, notasi sel, dan Eo sel yang tepat adalah ...
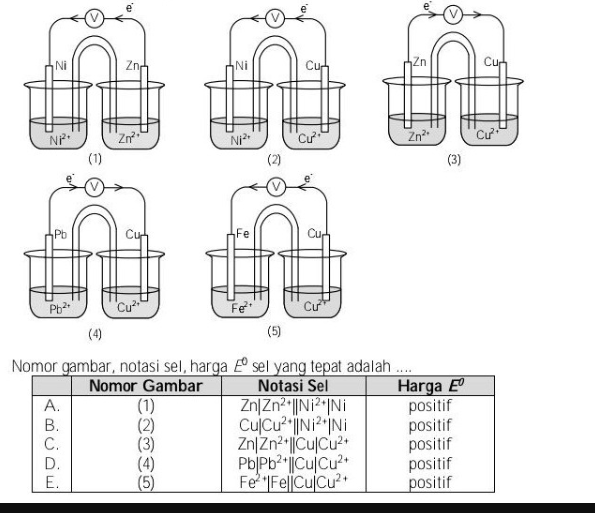
7
1
Iklan
Q. 'Ainillana
Mahasiswa/Alumni Universitas Negeri Yogyakarta
22 Februari 2023 04:46
<p>Jawaban yang benar adalah A.</p><p> </p><p>Sel volta merupakan sel elektrokimia yang reaksinya terjadi spontan, terdiri dari 2 bejana, salah satunya merupakan elektroda negatif (anoda) dan yang lainnya adalah elektroda positif (katoda) beserta larutannya. </p><p> </p><p>Pada anoda terjadi reaksi oksidasi dan pada katoda terjadi reaksi reduksi. Karena reaksi yang terjadi harus spontan, zat yang bertindak sebagai katoda adalah yang memiliki potensial reduksi standar (E°) lebih besar, sehingga potensial sel (E° sel) bernilai > 0 (bernilai positif). </p><p> </p><p>Untuk mengetahui urutan nilai E° jika tidak diketahui datanya pada soal adalah menggunakan deret volta seperti pada gambar terlampir. Semakin ke kanan, nilai E° semakin besar (lebih cenderung mengalami reduksi = katoda).</p><p> </p><p>Maka,</p><p>(1) E° Ni > E° Zn</p><p>Katoda: Ni</p><p>Anoda: Zn</p><p> </p><p>(2) E° Ni < E°Cu</p><p>Katoda: Cu</p><p>Anoda: Ni</p><p> </p><p>(3) E° Zn < E°Cu</p><p>Katoda: Cu</p><p>Anoda: Zn</p><p> </p><p>(4) E° Pb < E°Cu</p><p>Katoda: Cu</p><p>Anoda: Pb</p><p> </p><p>(5) E° Fe < E°Cu</p><p>Katoda: Cu</p><p>Anoda: Fe</p><p> </p><p>Elektron mengalir dari anoda ke katoda, maka sel (1), (3), dan (4) benar.</p><p> </p><p>Penulisan lambang (diagram) sel Volta tersebut adalah sebagai berikut:</p><p> </p><p>anoda || katoda</p><p> </p><p>dimana perubahan (oksidasi/reduksi) dibatasi dengan tanda |, sedangkan tanda || menunjukkan jembatan garam. Elektroda yang digunakan juga dicantumkan pada diagram sel, maka diagram sel Volta reaksi tersebut adalah:</p><p> </p><p>(1) Zn|Zn<sup>2+</sup> || Ni<sup>+</sup>|Ni</p><p>(3) Zn|Zn<sup>2+</sup> || Cu<sup>2+</sup>|Cu</p><p>(4) Pb|Pb<sup>2+</sup> || Cu<sup>2+</sup>|Cu</p><p> </p><p>Jadi, jawaban yang benar adalah gambar (1) Zn|Zn<sup>2+</sup> || Ni<sup>+</sup>|Ni, E° positif.</p>
Jawaban yang benar adalah A.
Sel volta merupakan sel elektrokimia yang reaksinya terjadi spontan, terdiri dari 2 bejana, salah satunya merupakan elektroda negatif (anoda) dan yang lainnya adalah elektroda positif (katoda) beserta larutannya.
Pada anoda terjadi reaksi oksidasi dan pada katoda terjadi reaksi reduksi. Karena reaksi yang terjadi harus spontan, zat yang bertindak sebagai katoda adalah yang memiliki potensial reduksi standar (E°) lebih besar, sehingga potensial sel (E° sel) bernilai > 0 (bernilai positif).
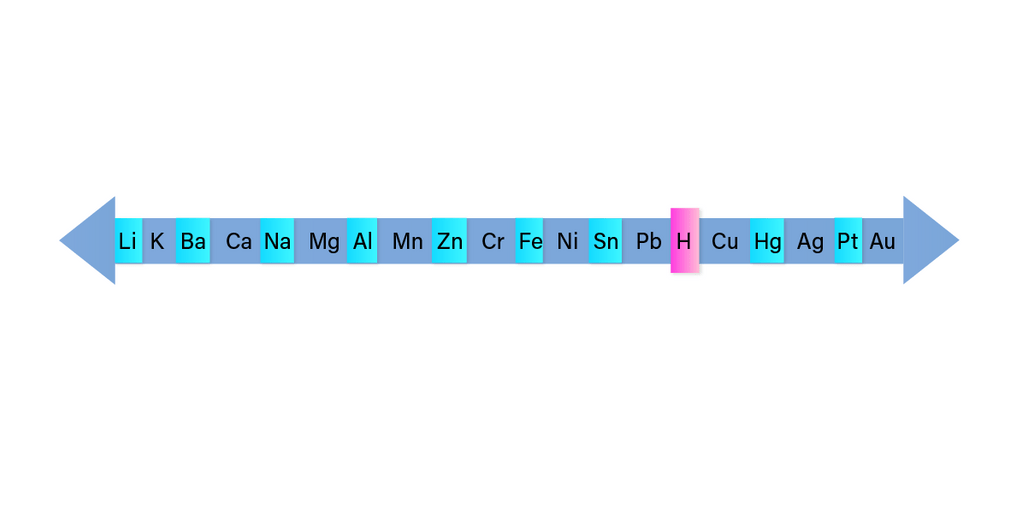
Untuk mengetahui urutan nilai E° jika tidak diketahui datanya pada soal adalah menggunakan deret volta seperti pada gambar terlampir. Semakin ke kanan, nilai E° semakin besar (lebih cenderung mengalami reduksi = katoda).
Maka,
(1) E° Ni > E° Zn
Katoda: Ni
Anoda: Zn
(2) E° Ni < E°Cu
Katoda: Cu
Anoda: Ni
(3) E° Zn < E°Cu
Katoda: Cu
Anoda: Zn
(4) E° Pb < E°Cu
Katoda: Cu
Anoda: Pb
(5) E° Fe < E°Cu
Katoda: Cu
Anoda: Fe
Elektron mengalir dari anoda ke katoda, maka sel (1), (3), dan (4) benar.
Penulisan lambang (diagram) sel Volta tersebut adalah sebagai berikut:
anoda || katoda
dimana perubahan (oksidasi/reduksi) dibatasi dengan tanda |, sedangkan tanda || menunjukkan jembatan garam. Elektroda yang digunakan juga dicantumkan pada diagram sel, maka diagram sel Volta reaksi tersebut adalah:
(1) Zn|Zn2+ || Ni+|Ni
(3) Zn|Zn2+ || Cu2+|Cu
(4) Pb|Pb2+ || Cu2+|Cu
Jadi, jawaban yang benar adalah gambar (1) Zn|Zn2+ || Ni+|Ni, E° positif.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



