AH
Ai H
30 Juni 2022 06:25
Iklan
AH
Ai H
30 Juni 2022 06:25
Pertanyaan
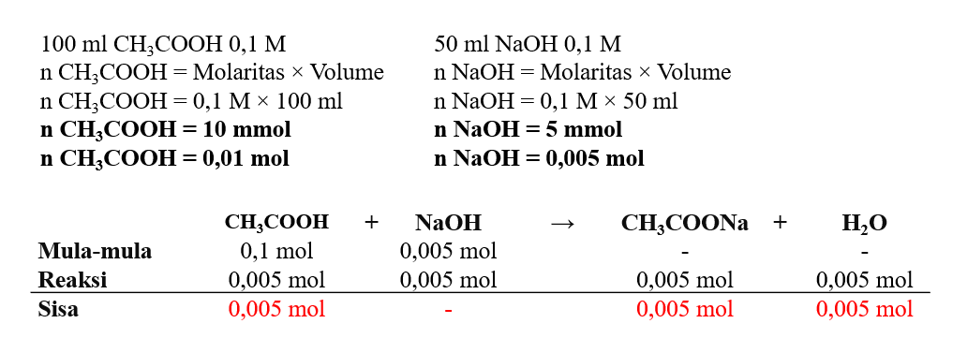
Mereaksikan 100 mL larutan CH3COOH 0,1 M dengan 50 mL larutan NaOH 0,1 M sehingga secara stoikiometri di dalam 150 mL campuran yang dihasilkan terdapat 0,005 mol CH3COOH (sisa reaksi) dan CH3COO^- (hasil reaksi). b. Hitung mol yang dihasilkan dengan menggunakan MBS (mula-mula, bereaksi, sisa)
8
2
Iklan
IW
I. Wulandari
Mahasiswa/Alumni Universitas Sebelas Maret
30 Juni 2022 06:43
Jawaban terverifikasi
Jawaban benar adalah mol CH3COOH = 0,005 mol, mol CH3COO^- = 0,005 mol dan mol H2O = 0,005 mol. Dalam perhitungan kimia, satuan mol (n) digunakan sebagai satuan jumlah.Mol (n) adalah satuan jumlah zat yang berukuran mikroskopis. Satu mol menunjukkan jumlah partikel yang terkandung dalam suatu zat. Dalam stoikiometri terdapat tabel yang diisi dengan jumlah zat yang terlibat dalam reaksi dalam satuan mol. Secara umum terdiri dari persaman reaksi, mula-mula, reaksi, sisa. Mol yang dihasilkan dari reaksi CH3COOH dan NaOH bisa dilihat pada gambar terlampir. Jadi, jawaban benar adalah mol CH3COOH = 0,005 mol, mol CH3COO^- = 0,005 mol dan mol H2O = 0,005 mol.
· 5.0 (1)
Iklan
NN
Nikita N
16 Mei 2024 15:52
40 ml CH3COOH (aq) 0,1 m(ka = 10 ^-6) dicampurkan dgn 80 ml NH4OH(aq) 0,1 m tentukan PH campuran tsb..
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



