ET
Eno T
05 Februari 2022 00:50
Iklan
ET
Eno T
05 Februari 2022 00:50
Pertanyaan
mengapa energi ionisasi unsur unsur periode ketiga dari kiri ke kanan makin besar kecuali Al dan Si
5
1
Iklan
YA
Y. Ayu
Mahasiswa/Alumni Universitas Negeri Malang
05 Februari 2022 09:11
Jawaban terverifikasi
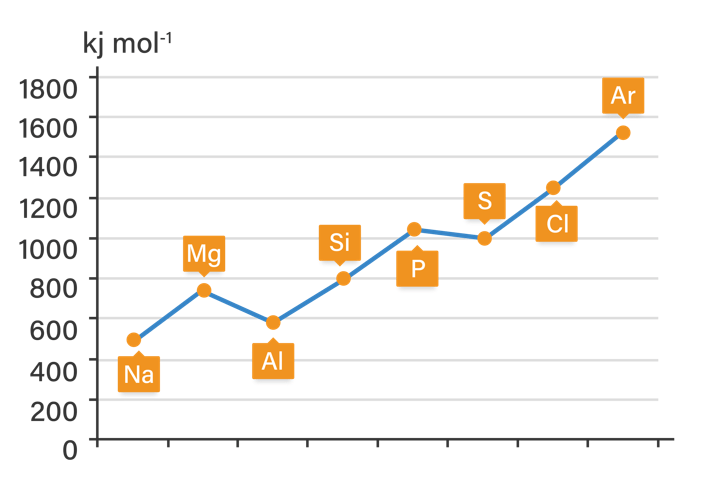
Hai Eno, kakak bantu jawab pertanyaanmu ya. Jawaban: Energi ionisasi Al dan S lebih kecil dan tidak mengikuti tren karena konfigurasi elektron Al dan S tidak stabil sebab tidak memenuhi aturan Hund yang menyatakan bahwa atom akan lebih stabil jika orbitalnya terisi penuh atau setengah penuh Sebelumnya, akan kakak ralat dulu pernyataan pada soal. Unsur yang memiliki energi ionisasi tidak sesuai tren adalah Al dan S bukan Al dan Si. Karena energi ionisasi Si sesuai dengan tren yaitu lebih besar dari Al tetapi lebih kecil dari P. Agar lebih jelas dapat dilihat grafik tren energi ionisasi unsur-unsur periode 3 pada gambar di lampiran. Energi ionisasi adalah energi yang diperlukan saat melepaskan satu elektron. Energi ionisasi unsur-unsur periode ketiga dari kiri ke kanan cenderung semakin besar. Tetapi terdapat sedikit anomali pada kecenderungan tersebut. Energi ionisasi Mg lebih besar daripada Al, demikian juga energi ionisasi P lebih besar daripada S. Anomali ini terjadi berkaitan dengan konfigurasi elektronnya. Konfigurasi elektron Mg, Al, P, dan S adalah: Mg = [Ne] 3s2 Al = [Ne] 3s2 3p1 P = [Ne] 3s2 3p3 S = [Ne] 3s2 3p4 Berdasarkan aturan Hund, suatu atom akan lebih stabil jika orbitalnya terisi penuh atau setengah penuh. Elektron valensi Mg telah mengisi penuh orbital s, sedangkan pada Al terdapat sebuah elektron pada orbital 3p yang tidak berpasangan. Maka, Mg lebih stabil dari Al dan Al lebih mudah melepaskan elektron sehingga energi ionisasi Al kecil. Sama halnya pada atom P dan atom S, atom P mempunyai tiga elektron valensi pada orbital p (setengah penuh) sedangkan atom S memiliki 4 elektron valensi. Konfigurasi elektron atom P lebih stabil daripada atom S karena orbital p dari atom P terisi penuh. Akibatnya, elektron S lebih mudah lepas dari P sehingga energi ionisasi S lebih kecil daripada P.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



