WR
Wiridania R
06 April 2022 14:17
Iklan
WR
Wiridania R
06 April 2022 14:17
Pertanyaan
Larutan penyangga dengan pH 4-log 3 dapat dibuat dengan mencampurkan 200 mal larutan asam format (Ka = 2×10-4) yang semula mempunyai pH 3- log 2 dengan 100 mal larutan natrium hidroksida dengan konsentrasi....
10
1
Iklan
SZ
S. Zulaihah
Mahasiswa/Alumni Universitas Negeri Surabaya
07 April 2022 05:37
Jawaban terverifikasi
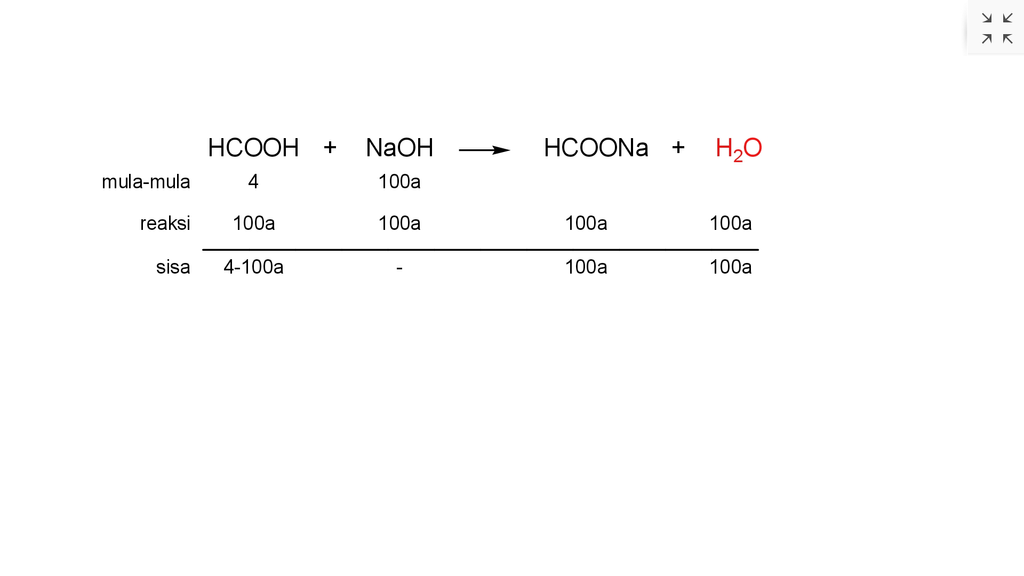
Hallo Wiridania, kakak bantu untuk menjawabnya, ya. Jawabannya adalah 0,016 M. Untuk lebih jelasnya, yuk disimak pembahasan berikut ini. Larutan penyangga merupakan larutan yang dapat mempertahankan nilai pH meskipun dengan penambahan asam, basa, atau air. Larutan penyangga terbagi menjadi 2 macam, yaitu penyangga asam dan penyangga basa. Larutan penyangga asam terdiri dari asam lemah dan basa konjugasinya (garam dari asam lemah tersebut). Misalnya, larutan HCOOH (asam lemah) dan larutan HCOONa (garam dari asam lemah HCOOH). Konsentrasi H+ larutan penyangga asam dapat ditentukan sebagai berikut. [H+] = Ka × (mol asam/mol garam) dimana Ka adalah tetapan ionisasi asam. ▪︎menentukan konsentrasi asam format (HCOOH) HCOOH merupakan asam lemah, konsentrasi ion H+ nya dapat ditentukan sebagai berikut. pH = 3 - log 2 [H+] = 2 × 10^-3 M [H+] = √(Ka × M) 2 × 10^-3 M = √((2 × 10^-4) × M HCOOH) (2×10^-3)² M = 2 × 10^-4 × M HCOOH 4 × 10^-6 M = 2 × 10^-4 × M HCOOH M HCOOH = 2 × 10^-2 M ▪︎menentukan mol asam dan basa a. mol HCOOH = M × V mol HCOOH = 2 × 10^-2 M × 200 ml mol HCOOH = 4 mmol b. mol NaOH = M × V mol NaOH = a M × 100 ml mol NaOH = 100a mmol ▪︎ reaksi asam basa Reaksi yang terjadi adalah HCOOH(aq) + NaOH(aq) ---> HCOONa(aq) + H2O(l) Karena terbentuk larutan penyangga asam, maka mol NaOH akan habis bereaksi sedangkan HCOOH bersisa. Perhitungannya seperti pada lampiran dibawah ini. ▪︎menentukan konsentrasi NaOH pH penyangga = 4-log 3 [H+] = 3 × 10^-4 M [H+] = Ka × (mol asam/mol garam) 3 × 10^-4 M = 2 × 10^-4 ((4-100a) mmol / 100a mmol) (3 × 10^-4 M) / (2 × 10^-4) = ((4-100a) mmol / 100a mmol) 1,5 = ((4-100a) mmol / 100a mmol) 150 a mmol = 4 mmol - 100a mmol 250 a mmol = 4 mmol a = 0,016 M Jadi, konsentrasi NaOH adalah 0,016 M.
· 1.0 (1)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



