MM
Maria M
29 Mei 2022 18:35
Iklan
MM
Maria M
29 Mei 2022 18:35
Pertanyaan
Larutan KCl dicampur dengan larutan AgNO3. Jika kedua larutan tersebut mempunyai volume sama. Campuran kedua larutan berikut yang tidak menghasilkan endapan adalah .... (Ksp AgCl = 1,8 x 10^-10) a. KCl 1 x 10^-3 M dan AgNO3 5 x 10^-4 M b. KCl 1 x 10^-3 M dan AgNO3 5 x 10^-5 M c. KCl 2 x 10^-4 M dan AgNO3 1,5 x 10^-3 M d. KCl 5 x 10^-5 M dan AgNO3 1 x 10^-5 M e. KCl 1,5 x 10^-5 M dan AgNO3 1 x 10^-4 M
8
1
Iklan
YL
Y. Lutvira
30 Mei 2022 04:38
Jawaban terverifikasi
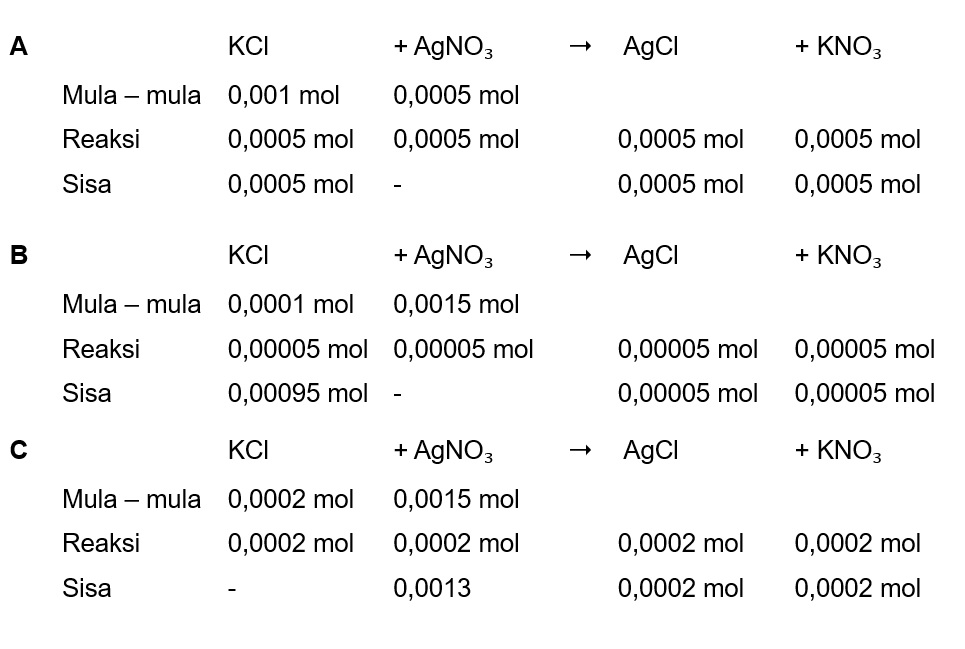
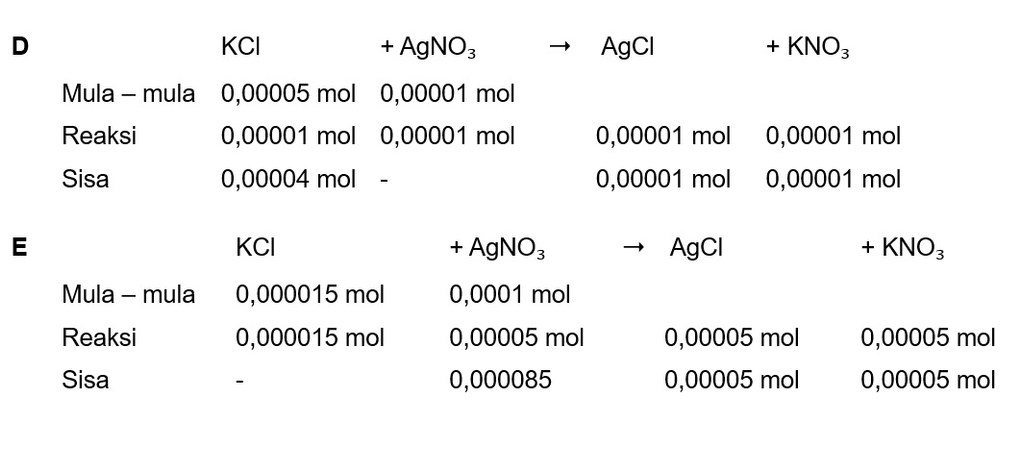
Jawaban yang benar adalah D Hasil kali kelarutan (Ksp) merupakan sebuah tetapan yang didapatkan dari hasil kali konsentrasi ion pada kondisi larutan tersebut jenuh setelah dipangkatkan dengan nilai koefisien dari persamaan ionisasinya. Konsentrasi ion senama sangat berpengaruh pada sifat kelarutan suatu zat. Penambahan ion senama bisa mengurangi kelarutan suatu zat. Artinya, semakin banyak ion senama di dalam larutan, zat-zat terlarut semakin sulit untuk larut. Jika Qsp < Ksp, maka larutan belum jenuh (tidak terjadi endapan). Jika Qsp = Ksp, maka larutan tepat jenuh (mulai terjadi endapan). Jika Qsp > Ksp, maka larutan lewat jenuh (mengendap). A. KCl + AgNO₃ ➝ AgCl + KNO₃ Menentukan mol KCl, jika volume 1 L mol KCl = molaritas x volume mol KCl = 0,001 M x 1 L mol KCl = 0,001 mol Menentukan mol AgNO₃, jika volume 1 L mol AgNO₃ = molaritas x volume mol AgNO₃ = 0,0005 M x 1 L mol AgNO₃ = 0,0005 mol Mol mula-mula reaksi setimbang terlampir Mol AgCl = 0,0005 mol Volume AgCl dianggap 2 L karena volume KCl 1 L ditambah 1L AgNO₃ Menentukan molaritas AgCl Molaritas = mol : volume Molaritas = 0,0005 mol : 2L Molaritas = 0,001 = 10⁻³ M Reaksi ion-ion AgCl AgCl ➝ Ag⁺ + Cl⁻ AgCl = s Ag⁺ = s Cl⁻ = s s = 10⁻³ M Menentukan Qsp Qsp = [Ag⁺] [Cl⁻] Qsp = 10⁻³ x 10⁻³ Qsp = 10⁻⁶ Karena nilai Ksp AgCl 1,8 x 10⁻¹⁰ maka Ksp < Qsp, larutan mengendap. B. KCl + AgNO₃ ➝ AgCl + KNO₃ Menentukan mol KCl, jika volume 1 L mol KCl = molaritas x volume mol KCl = 0,001 M x 1 L mol KCl = 0,001 mol Menentukan mol AgNO₃, jika volume 1 L mol AgNO₃ = molaritas x volume mol AgNO₃ = 0,00005 M x 1 L mol AgNO₃ = 0,00005 mol Mol mula-mula reaksi setimbang terlampir Mol AgCl = 0,00005 mol Volume AgCl dianggap 2 L karena volume KCl 1 L ditambah 1L AgNO₃ Menentukan molaritas AgCl Molaritas = mol : volume Molaritas = 0,00005 mol : 2L Molaritas = 0,000025 = 2,5 x10⁻⁵ M Reaksi ion-ion AgCl AgCl ➝ Ag⁺ + Cl⁻ AgCl = s Ag⁺ = s Cl⁻ = s s = 2,5 x10⁻⁵ M Menentukan Qsp Qsp = [Ag⁺] [Cl⁻] Qsp = 2,5 x10⁻⁵ x 2,5 x10⁻⁵ Qsp = 6,25 x10⁻¹⁰ Karena nilai Ksp AgCl 1,8 x 10⁻¹⁰ maka Ksp < Qsp, larutan mengendap. C. KCl + AgNO₃ ➝ AgCl + KNO₃ Menentukan mol KCl, jika volume 1 L mol KCl = molaritas x volume mol KCl = 0,0002 M x 1 L mol KCl = 0,0002 mol Menentukan mol AgNO₃, jika volume 1 L mol AgNO₃ = molaritas x volume mol AgNO₃ = 0,0015 M x 1 L mol AgNO₃ = 0,0015 mol Mol mula-mula reaksi setimbang terlampir Mol AgCl = 0,0002 mol Volume AgCl dianggap 2 L karena volume KCl 1 L ditambah 1L AgNO₃ Menentukan molaritas AgCl Molaritas = mol : volume Molaritas = 0,0002 mol : 2L Molaritas = 0,0001 M = 10⁻⁴ M Reaksi ion-ion AgCl AgCl ➝ Ag⁺ + Cl⁻ AgCl = s Ag⁺ = s Cl⁻ = s s = 10⁻⁴ M Menentukan Qsp Qsp = [Ag⁺] [Cl⁻] Qsp = 10⁻⁴ x 10⁻⁴ Qsp = 10⁻⁸ Karena nilai Ksp AgCl 1,8 x 10⁻¹⁰ maka Ksp < Qsp, larutan mengendap. D. KCl + AgNO₃ ➝ AgCl + KNO₃ Menentukan mol KCl, jika volume 1 L mol KCl = molaritas x volume mol KCl = 0,00005 M x 1 L mol KCl = 0,00005 mol Menentukan mol AgNO₃, jika volume 1 L mol AgNO₃ = molaritas x volume mol AgNO₃ = 0,00001 M x 1 L mol AgNO₃ = 0,00001 mol Mol mula-mula reaksi setimbang terlampir Mol AgCl = 0,00001 mol Volume AgCl dianggap 2 L karena volume KCl 1 L ditambah 1L AgNO₃ Menentukan molaritas AgCl Molaritas = mol : volume Molaritas = 0,00001 mol : 2L Molaritas = 0,000005 M = 5 x 10⁻⁶ M Reaksi ion-ion AgCl AgCl ➝ Ag⁺ + Cl⁻ AgCl = s Ag⁺ = s Cl⁻ = s s = 5 x 10⁻⁶ M Menentukan Qsp Qsp = [Ag⁺] [Cl⁻] Qsp = 5 x 10⁻⁶ x 5 x 10⁻⁶ Qsp = 25 x 10⁻¹² Karena nilai Ksp AgCl 1,8 x 10⁻¹⁰ maka Ksp > Qsp, larutan tidak mengendap. E. KCl + AgNO₃ ➝ AgCl + KNO₃ Menentukan mol KCl, jika volume 1 L mol KCl = molaritas x volume mol KCl = 0,000015 M x 1 L mol KCl = 0,000015 mol Menentukan mol AgNO₃, jika volume 1 L mol AgNO₃ = molaritas x volume mol AgNO₃ = 0,0001 M x 1 L mol AgNO₃ = 0,0001 mol Mol mula-mula reaksi setimbang terlampir Mol AgCl = 0,00005 mol Volume AgCl dianggap 2 L karena volume KCl 1 L ditambah 1L AgNO₃ Menentukan molaritas AgCl Molaritas = mol : volume Molaritas = 0,00005 mol : 2L Molaritas = 0,000025 M = 25 x 10⁻⁶ M Reaksi ion-ion AgCl AgCl ➝ Ag⁺ + Cl⁻ AgCl = s Ag⁺ = s Cl⁻ = s s = 25 x 10⁻⁶ M Menentukan Qsp Qsp = [Ag⁺] [Cl⁻] Qsp = 25 x 10⁻⁶ x 25 x 10⁻⁶ Qsp = 6,25 x 10⁻¹⁰ Karena nilai Ksp AgCl 1,8 x 10⁻¹⁰ maka Ksp < Qsp, larutan mengendap. Jadi jawabannya campuran kedua larutan berikut yang tidak menghasilkan endapan adalah KCl 5 x 10⁻⁵M dan AgNO₃ 1 x 10⁻⁵ M
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



