Nurul A
13 Agustus 2022 05:58
Iklan
Nurul A
13 Agustus 2022 05:58
Pertanyaan
Larutan 25 ml HCN 0,2 M dereaksikan dengan 25 ml NaOH 0,2 M. sesuai dengan reaksi: HCN (aq) + NaOH (aq) → NaCN (aq) +H2O (l) jika Ka HCN = 10 -5 , maka PH campuran yang terjadi adalah a . 5-log 1 b. 7+log 1 c. 9+log 1 d.13-log 2 e. 13+log 2
11
2
Iklan
A. Chusna
03 Oktober 2022 06:47
<p>Jawaban dari pertanyaan di atas adalah 9+ log 1 (C).</p><p> </p><p>Reaksi antara larutan HCN dengan larutan NaOH akan terbentuk tiga kemungkinan yaitu antara larutan penyangga asam atau hidrolisis atau bersifat basa kuat. Jika setelah reaksi yang tersisa adalah asam lemah dan garamnya maka terbentuk larutan penyangga asam, tetapi jika yang tersisa hanya garamnya dan asam lemah tidak bersisa maka terbentuk hidrolisis. Jika setelah reaksi ada zat sisa NaOH (basa kuat) maka bersifat basa kuat. Penentuan zat yang tersis melalui perhitungan stoikiometri seperti berikut ini.</p><p> </p><p>- Menentukan mol HCN dan NaOH</p><p>n HCN = [HCN] x volume HCN</p><p>n HCN = 0,2 M x 25 mL</p><p>n HCN = 5 mmol</p><p> </p><p>n NaOH = [NaOH] x volume NaOH</p><p>n NaOH = 0,2 M x 25 mL</p><p>n NaOH = 5 mmol</p><p> </p><p>- Menentukan mol zat sisa </p><p>HCN (aq) + NaOH (aq) --> NaCN(aq) + H<sub>2</sub>O (l)</p><p> </p><p>(Perhitungan stoikiometri terlampir di gambar) </p><p> </p><p>zat yang bersisa adalah NaCN 5 mmol. Dengan demikian, Zat tersebut merupakan hidrolisis. Reaksi hidrolisis CN- seperti berikut ini.</p><p>CN- (aq) + H<sub>2</sub>O (l) ⇌ HCN (aq) + OH- (aq)</p><p> </p><p>- Menentukan [OH-]</p><p>[CN-] = [NaCN]</p><p>[NaCN] = n NaCN / volume NaCN</p><p>[NaCN] = 5 mmol / 50 mL</p><p>[NaCN] = 0,1 M</p><p> </p><p>[OH-] = 10<sup>-5</sup> M</p><p> </p><p>- Menentukan pH</p><p>pOH = - log [OH-]</p><p>pOH = - log 1x10<sup>-5</sup> </p><p>pOH = 5 - log 1</p><p>pH + pOH = 14</p><p>pH = 9+ log 1</p><p> </p><p>Jadi pH campuran di atas adalah 9 + log 1.</p><p> </p><p> </p><p> </p>
Jawaban dari pertanyaan di atas adalah 9+ log 1 (C).
Reaksi antara larutan HCN dengan larutan NaOH akan terbentuk tiga kemungkinan yaitu antara larutan penyangga asam atau hidrolisis atau bersifat basa kuat. Jika setelah reaksi yang tersisa adalah asam lemah dan garamnya maka terbentuk larutan penyangga asam, tetapi jika yang tersisa hanya garamnya dan asam lemah tidak bersisa maka terbentuk hidrolisis. Jika setelah reaksi ada zat sisa NaOH (basa kuat) maka bersifat basa kuat. Penentuan zat yang tersis melalui perhitungan stoikiometri seperti berikut ini.
- Menentukan mol HCN dan NaOH
n HCN = [HCN] x volume HCN
n HCN = 0,2 M x 25 mL
n HCN = 5 mmol
n NaOH = [NaOH] x volume NaOH
n NaOH = 0,2 M x 25 mL
n NaOH = 5 mmol
- Menentukan mol zat sisa
HCN (aq) + NaOH (aq) --> NaCN(aq) + H2O (l)
(Perhitungan stoikiometri terlampir di gambar)
zat yang bersisa adalah NaCN 5 mmol. Dengan demikian, Zat tersebut merupakan hidrolisis. Reaksi hidrolisis CN- seperti berikut ini.
CN- (aq) + H2O (l) ⇌ HCN (aq) + OH- (aq)
- Menentukan [OH-]
[CN-] = [NaCN]
[NaCN] = n NaCN / volume NaCN
[NaCN] = 5 mmol / 50 mL
[NaCN] = 0,1 M
[OH-] = 10-5 M
- Menentukan pH
pOH = - log [OH-]
pOH = - log 1x10-5
pOH = 5 - log 1
pH + pOH = 14
pH = 9+ log 1
Jadi pH campuran di atas adalah 9 + log 1.
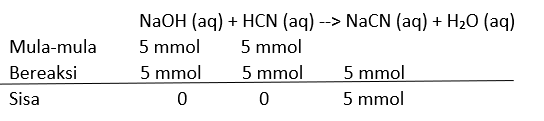
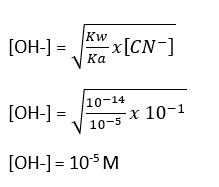
· 0.0 (0)
Iklan
Reva F
30 Maret 2023 02:04
Sebanyak 25 mL HCN 0,2 M direaksikan dengan 25 mL NaOH 0,2 M. Sesuai dengan reaksi : HCN (aq) + NaOH (aq) → NaCN (aq) + H2O (l) Jika Ka HCN = 10-5 , maka pH campuran yang terjadi adalah …. :
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



