AJ
Aileen J
10 Februari 2022 05:38
Iklan
AJ
Aileen J
10 Februari 2022 05:38
Pertanyaan
Kalium hidroksida (KOH) mudah bereaksi dengan karbon dioksida (CO2) untuk menghasilkan kalium karbonat (K2CO3) dan air (H2O). Tentukan massa kalium karbonat yang dihasilkan jika 224,4 g KOH direaksikan dengan 88,0 g CO2danmenghasilkan 36,0gram air!
1
1
Iklan
DA
D. Aprilia
Mahasiswa/Alumni Universitas Pendidikan Indonesia
07 Maret 2022 12:20
Jawaban terverifikasi
Halo Aileen, kakak bantu jawab yaa :) Jadi, massa K2CO3 yang dihasilkan sebanyak 276 gram. Simak perhitungannya berikut ini. Reaksi KOH dan CO2 kita tuliskan dahulu sebagai reaksi yang setara. Perhitungan massa K2CO3 dapat dihitung menggunakan tabel m.r.s (mula-mula, reaksi, zat sisa reaksi). Pada soal diketahui : massa mula-mula KOH = 224,4 g massa mula-mula CO2 = 88 g massa H2O hasil reaksi = 36 g Reaksi setaranya : 2KOH + CO2 → K2CO3 + H2O Satuan yang kita masukkan ke dalam tabel m.r.s adalah jumlah mol. Mol zat dapat ditentukan dengan membagi massa zat terhadap Mr nya (massa molekul relatif). Mr ini adalah jumlah massa atom relatif setiap unsur yang terdapat dalam zat tersebut. Massa atom relatif (Ar) dapat diketahui dari tabel periodik unsur. Ar K = 39 ; Ar O = 16 ; Ar H = 1 ; Ar C = 12 Mr KOH = 56 g/mol Mr CO2 = 44 g/mol Mr K2CO3 = 138 g/mol Mr H2O = 18 g/mol Sehingga, mol mula-mula KOH = 224,4 g / 56 g.mol¯¹ = 4mol mol mula-mula CO2 = 88 g / 44 g.mol¯¹ = 2 mol mol H2O hasil reaksi = 36 g / 18 g.mol¯¹ = 2 mol Perhatikan tabel m.r.s pada gambar yang terlampir. Karena mol H2O hasil reaksi adalah 2 mol, maka "r" atau "mol yang bereaksi" nya juga 2 mol. Untuk "r" senyawa lain digunakan perbandingan koefisien sehingga didapat "r" untuk KOH -4 mol, "r" CO2 = -2 mol dan "r" K2CO3 = 2 mol. Pada sisa reaksi terdapat 2 mol K2CO3. Hubungan massa dengan mol : massa = mol × Mr massa K2CO3 = 2 mol × 138 g/mol massa K2CO3 = 276 g
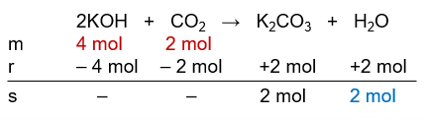
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



