RR
Rafi R
21 Juli 2022 14:04
Iklan
RR
Rafi R
21 Juli 2022 14:04
Pertanyaan
Jika reaksi antara 6,0 gram etana C2H6 (M, = 30) dengan 7,1 gram Cl2 (M, = 71) menghasilkan 5,16 gram C2H5Cl (M, = 64,5), maka persen rendemen etil klorida adalah ....
2
1
Iklan
AC
A. Chusna
20 Agustus 2022 05:52
Jawaban terverifikasi
Jawaban dari pertanyaan di atas adalah 80%. Reaksi antara gas etana dengan gas klorida menghasilkan gas etil klorida dan asam klorida. Persamaan reaksi tersebut dapat dituliskan seperti berikut ini. C₂H₆ (g) + Cl₂ (g) --> C₂H₅Cl (g) + HCl (aq) Persen randemen etil klorida merupakan persentase massa yang diperoleh dari percobaan dibagi massa secara teoritis atau dapat dituliskan seperti berikut ini. % randemen = (massa sebenarnya / massa teoritis) x 100% Massa etil klorida sebenarnya atau massa yang diperoleh dari hasil percobaan adalah 5,16 gram. Sedangkan massa teoritis perlu dicari menggunakan perhitungan stoikiometri seperti berikut ini. - Menentukan mol awal C₂H₆ dan Cl₂ C₂H₆ (g) + Cl₂ (g) --> C₂H₅Cl (g) + HCl (aq) mol C₂H₆ = massa C₂H₆ x Mr ₂H₆ mol C₂H₆ = 6 gram / 30 gram/mol mol C₂H₆ = 0,2 mol mol Cl₂ = massa Cl₂ x Mr Cl₂ mol Cl₂ = 7,1 gram / 71 gram/mol mol Cl₂ = 0,1 mol - Menentukan pereaksi pembatas Untuk menentukan pereaksi pembatas, Mol mula-mula setiap reaktan dibagi dengan koefisiennya. Reaktan dengan hasil bagi yang lebih kecil merupakan pereaksi pembatas. mol C₂H₆/ koefisien C₂H₆ = 0,2 / 1 = 0,2 mol Cl₂ / koefisien Cl₂ = 0,1 / 1 = 0,1 Nilai perbandingan mol Cl₂ dengan koefisiennya memiliki nilai yang lebih kecil sehingga pereaksi pembatasnya adalah Cl₂. - Menentukan zat sisa dan mol etil klorida zat yang tersisa adalah etana sebesar 0,1 mol dan etil klorida yang terbentuk adalah 0,1 mol. (perhitungan terlampir di gambar) - Menentukan massa teoritis etil klorida massa etil klorida = mol etil klorida x Mr etil klorida massa etil klorida = 0,1 mol x 64,5 gram/mol massa etil klorida = 6,45 gram - Menentukan randemen % randemen = (massa sebenarnya / massa teoritis) x 100 % % randemen = (5,16 gram/6,45 gram) x 100% % randemen = 80 % Jadi randemen etil klorida adalah 80%.
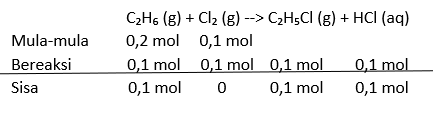
· 5.0 (1)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



