NA
Nurul A
29 Maret 2022 15:39
Iklan
NA
Nurul A
29 Maret 2022 15:39
Pertanyaan
Hitunglah pH larutan sebelum dan sesudah bereaksi panda pasanga larutan : 50 mL CH3COOH(aq) 0,1 M + 50 mL NaOH (aq) 0,1 M
1
1
Iklan
YA
Y. Ayu
30 Maret 2022 14:57
Jawaban terverifikasi
Hai Nurul, kakak bantu jawab pertanyaanmu ya. Jawaban: pH NaOH = 13 pH CH3COOH = 3 pH campuran = 8 + log 7 CH3COOH merupakan asam lemah dan NaOH adalah basa kuat. Sebelum menentukan pH campuran, maka perlu ditentukan dahulu sisa zat setelah bereaksi. Rumus perhitungan pH basa kuat: [OH-] = x . M pH = 14 - pOH pOH = – log [OH-] keterangan: [OH-] = konsentrasi ion OH- x = valensi basa (jumlah ion OH-) M = molaritas Valensi basa dari NaOH adalah 1 karena NaOH dapat melepaskan 1 ion OH- dalam air. NaOH → Na+ + OH- pH larutan NaOH sebelum dicampurkan adalah: [OH-] = x . M [OH-] = 1 . 0,1 M = 0,1 M = 10^-1 M pOH = – log [OH-] pOH = – log 10^-1 = 1 pH = 14 - pOH pH = 14 - 1 = 13 Rumus perhitungan pH asam lemah: [H+] = √Ka x Ma pH = – log [H+] keterangan: [H+] = konsentrasi ion H+ Ka = tetapan ionisasi asam Ma = molaritas asam Nilai Ka tidak diketahui pada soal. Namun berdasarkan literatur, besarnya Ka dari CH3COOH yang biasa digunakan adalah 10^-5. pH larutan CH3COOH sebelum dicampurkan adalah: [H+] = √Ka x Ma [H+] = √10^-5 x 0,1 M [H+] = 10^-3 M pH = – log [H+] pH = - log 10^-3 pH = 3 Mol NaOH dan CH3COOH adalah: n = M x V n NaOH = 0,1 M x 50 mL = 5 mmol n CH3COOH = 0,1 M x 50 mL = 5 mmol Reaksi dan jumlah mol yang bereaksi dapat dilihat pada gambar di lampiran. CH3COONa adalah garam basa yang dapat mengalami hidrolisis parsial. Hidrolisis parsial merupakan hidrolisis garam yang memiliki 1 ion yang terhidrolisis, misalnya anion (ion negatif) atau kation (ion positif) saja, karena garam terbentuk dari asam kuat dan basa lemah, atau asam lemah dan basa kuat. CH3COONa → CH3COO- + Na+ CH3COO- + H2O ⇌ CH3COOH + OH- Na+ + H2O ↛ Rumus perhitungan pH nya adalah: [OH-] = √(Kw/Ka x M) pOH = -log [OH-] pH = 14-pOH Konsentrasi CH3COONa: M = n/V total = 5 mmol/100 mL = 0,05 M = 5 x 10^-2 M Maka, pH CH3COONa adalah: [OH-] = √(Kw/Ka x M) [OH-] = √(10^-14/10^-5 x 5 x 10^-2 M) [OH-] = √(5 x 10^-11 M) [OH-] = 7 x 10^-6 M pOH = -log [OH-] pOH = -log 7 x 10^-6 pOH = 6 - log 7 pH = 14-pOH pH = 14 - (6 - log 7) pH = 8 + log 7
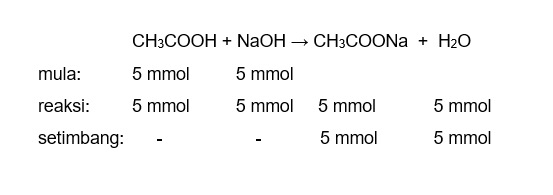
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



