AM
Andi M
07 April 2022 08:21
Iklan
AM
Andi M
07 April 2022 08:21
Pertanyaan
Hitunglah pH larutan asam dan basa lemah berikut. b. Larutan NH4OH 0,02M (Kb = 1,8 x 10^-5)
3
1
Iklan
YY
Y. Yeni
Mahasiswa/Alumni Universitas Negeri Padang
07 April 2022 08:47
Jawaban terverifikasi
Halo dek andi M kakak bantu jawab ya jawabannya: pH NH4OH adalah 10 + log 6 NH4OH merupakan senyawa basa lemah. Menghitung nilai pH dari suatu basa lemah; [OH-] =√(𝐾𝑏. 𝑀 ) [OH-] = konsentrasi OH (Molar) kb = tetapan basa M = konsentrasi basa ( Molar ) Tentukan dahulu [OH-] dari senyawa NH4OH, lalu cari pOH menggunakan; pOH = - log [OH-] Setelah dapat pOH maka dapat ditentukan pH; pH = 14 - pOH jadi pH dari NH4OH adalah 10 + log 6 Semoga dapat membantu ya dek.
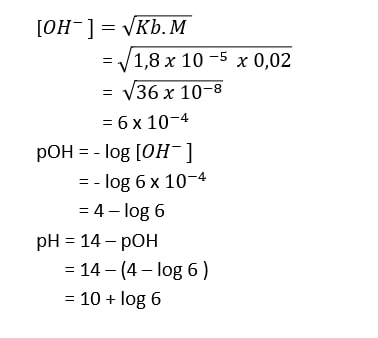
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



