AM
Andi M
20 Maret 2022 15:42
Iklan
AM
Andi M
20 Maret 2022 15:42
Pertanyaan
Hitung pH campuran : d. 50 mL H2SO4 0,2 M + 50 mL NaOH 0,2M
2
1
Iklan
MA
M. Ariefin
22 Maret 2022 02:22
Jawaban terverifikasi
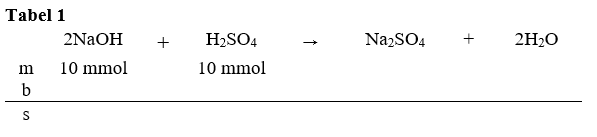
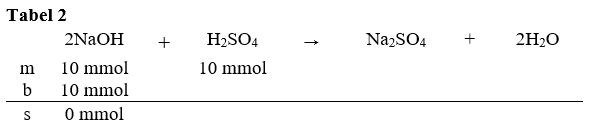
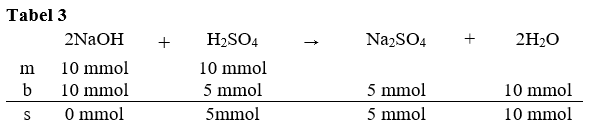
Halo Andi, saya bantu jawab ya. Jawaban yang tepat adalah 1,00. Untuk menyelesaikan soal ini, kita terlebih dahulu harus mereaksikan kedua senyawa dan mencari yang tersisa dari reaksi tersebut. 1. Langkah pertama kita hitung terlebih dahulu mol dari NaOH dan H₂SO₄. mol NaOH = M x V = 0,2 M x 50 mL = 10 mmol mol H₂SO₄ = M x V = 0,2 M x 50 mL = 10 mmol 2. Langkah kedua reaksikan keduanya. Karena NaOH merupakan suatu basa dan H₂SO₄ adalah asam, maka reaksi yang terjadi adalah reaksi penetralan. Reaksi ini akan menghasilkan produk garam dan air. Reaksi yang tepat adalah sebagai berikut. 2NaOH + H₂SO₄ → Na₂SO₄ + 2H₂O 3. Langkah ketiga, susun tabel mbs (mula-mula, bereaksi, dan sisa). Lebih jelasnya bisa dilihat pada gambar tabel 1. Kemudian kita cari pereaksi pembatas dari reaksi ini. Cara menentukan pereaksi pembatas dengan cara membagi mol dengan koefisien. Hasil bagi terkecil bertindak sebagai pereaksi pembatas. hasil bagi NaOH = 10 / 2 = 5 hasil bagi H₂SO₄ = 10 / 1 = 10 Karena hasil bagi NaOH lebih kecil, maka NaOH bertindak sebagai pereaksi pembatas (reaktan yang habis lebih dulu). Untuk tabel mbs nya dapat dilihat pada gambar tabel 2. 4. Tentukan kolom b dan s pada tabel 'mbs'. NaOH habis lebih dahulu. Untuk menentukan komponen senyawa lain di 'b' maka bisa menggunakan perbandingan koefisien antara senyawa lain dengan NaOH. untuk mencari H₂SO₄yang bereaksi, maka kita gunakan perbandingan koefisiennya. mol H₂SO₄ bereaksi = koefisien H₂SO₄/koefisien NaOH x mol NaOH = 1/2 x 10 = 5 mmol maka mol H₂SO₄ yang tersisa adalah mol sisa = mol awal - mol bereaksi = 10 mmol - 5 mmol = 5 mmol Untuk lebih jelasnya, bisa dilihat pada gambar tabel 3. 5. Karena yang tersisa asam kuat, maka asam kuat akan terionisasi sempurna menjadi H₂SO₄ → 2H⁺ + SO₄²⁻. Berdasarkan koefisiennya, nilai mol H⁺ = 2 x mol SO₄²⁻. mol H⁺ = 2 x mol SO₄²⁻. mol H⁺ = 2 x 5 mmol = 10 mmol 6. Kita hitung nilai konsentrasi H⁺. [H⁺] = mol H⁺ / V total [H⁺] = 10 mmol / (50 mL + 50 mL) = 0,1 M 7 . Setelah mengetahui nilia [H⁺], kita hitung nilai pHnya pH = - log [H⁺] = -log 0,1 = 1 Jadi nilai pH campuran adalah 1.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



