MM
Maria M
30 Desember 2021 15:09
Iklan
MM
Maria M
30 Desember 2021 15:09
Pertanyaan
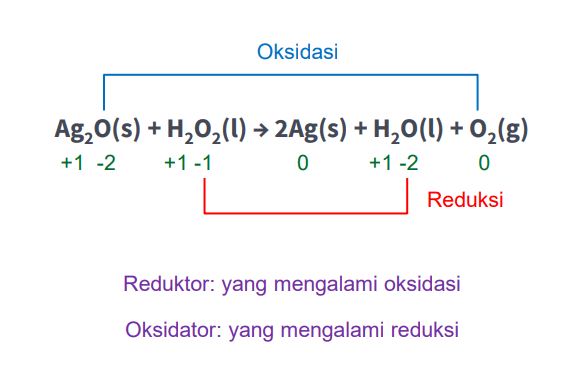
Hidrogen peroksida, H2O2, bereaksi dengan perak oksida mengikuti reaksi berikut: Ag2O(s) + H2O2(l) → 2Ag(s) + H2O(l) + O2(g) Pada reaksi tersebut, hidrogen peroksida berfungsi sebagai .... A. dehidrator B. reduktor C. basa D. oksidator e. asam
9
1
Iklan
AY
A. Yanti
15 Januari 2022 06:26
Hallo Maria M, jawaban untuk soal ini yaitu D, H2O2 sebagai oksidator. Untuk lebih jelasnya, yuk simak pembahasan berikut ^_^ Reaksi redoks merupakan singkatan dari reduksi dan oksidasi. Reaksi redoks memiliki 3 konsep, yaitu: 1. Berdasarkan pelepasan dan pengikatan oksigen 2. Berdasarkan transfer elektron 3. Berdasarkan perubahan bilangan oksidasi (biloks) Pada reaksi di atas, konsep yang digunakan adalah reaksi redoks berdasarkan perubahan bilangan oksidasi ya. Reaksi reduksi merupakan reaksi yang terjadi karena adanya penurunan biloks , sedangkan reaksi oksidasi terjadi karena adanya peningkatan biloks. Bilangan oksidasi (biloks) ini merupakan muatan positif dan negatif yang terdapat pada suatu atom. Biasanya nilai biloks akan sama dengan muatan yang dimiliki suatu atom. Dari reaksi yang diketahui, kita perlu menentukan terlebih dahulu biloks masing-masing unsurnya yang merujuk pada aturan biloks. Aturan biloks yang akan digunakan yaitu: - jumlah biloks unsur-unsur yang membentuk senyawa netral = 0. - biloks unsur bebas = 0. - biloks H = +1 kecuali berikatan dengan logam - biloks O = -2 kecuali pada peroksida dan superoksida 1) Senyawa Ag2O Senyawa Ag2O membentuk senyawa netral. Biloks O = -2, maka biloks Ag adalah: muatan Ag2O = 2(biloks Ag) + biloks O 0 = 2(biloks Ag) + (-2) biloks Ag = (0 + 2)/2 biloks Ag = +1 2) Senyawa H2O2 Senyawa H2O2 membentuk senyawa netral. Biloks H = +1, karena ini senyawa peroksida maka biloks O adalah: muatan H2O2 = 2(biloks H) + 2(biloks O) 0 = 2(+1) + 2(biloks O) biloks O = (0 - 2)/2 biloks O = -1 3)Unsur Ag Ag merupakan unsur bebas yang berbentuk atom tunggal, biloksnya adalah 0. 4) Senyawa H2O biloks H = +1 dan biloks O = -2. 5)Senyawa O2 O2 merupakan unsur bebas yang berbentuk molekul, biloksnya adalah 0. Setelah mengetahui biloks masing-masing, apabila kita lihat pada gambar ditinjau dari perubahan biloks O pada kedua reaktan, terjadi perubahan biloks O pada H2O2 yaitu dari -1 menjadi -2 pada senyawa H2O (reduksi). Kemudian biloks O pada Ag2O berubah dari -2 menjadi 0 pada senyawa O2 (oksidasi). Ag2O berperan sebagai reduktor karena mengalami oksidasi, maka H2O2 berperan sebagai oksidator karena mengalami reduksi. Semoga bermanfaat ya ^_^
· 1.0 (1)
Iklan
Mau jawaban yang terverifikasi?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



