Ana A
13 Agustus 2022 07:34
Iklan
Ana A
13 Agustus 2022 07:34
Pertanyaan
hibridisasi dari h2o nh3 dan ch4
4
1
Iklan
Q. 'Ainillana
Mahasiswa/Alumni Universitas Negeri Yogyakarta
28 September 2022 03:20
<p>Hibridisasi dari H<sub>2</sub>O, NH<sub>3</sub>, dan CH<sub>4</sub> adalah sp<sup>3.</sup> </p><p> </p><p>Hibridisasi adalah peleburan orbital-orbital dari tingkat energi yang berbeda menjadi orbital-orbital yang energinya setingkat atau setara. Orbital yang dimaksud adalah orbital-orbital pada kulit terakhir atom yang berikatan. Untuk itu, perlu diketahui konfigurasi elektron H, O, N, dan C.</p><p> </p><p><sub>1</sub>H = 1s<sup>1</sup> (elektron valensi: 1)<br><sub>8</sub>O = [He] 2s<sup>2</sup> 2p<sup>4</sup> (elektron valensi: 6)</p><p><sub>7</sub>N = [He] 2s<sup>2</sup> 2p<sup>3</sup> (elektron valensi: 5)</p><p><sub>6</sub>C = [He] 2s<sup>2</sup> 2p<sup>2</sup> (elektron valensi: 4)</p><p> </p><p>Berdasarkan konfigurasi elektron tersebut, atom O memiliki elektron valensi yang berada pada 2s dan 2p (kulit 2). Pada keadaan dasar, 6 elektron terisi pada 2s dan 2p. Kemudian ada 2 atom H yang akan berikatan, dimana masing-masing atom H membutuhkan 1 elektron lagi agar stabil (duplet). Karena ada dua orbital yang sudah tersedia masing-masing dengan satu elektron, 2 atom H dapat berikatan dengan O, yaitu melalui masing-masing elektron tak berpasangan yang dimiliki O dan H. Perhatikan gambar terlampir.</p><p> </p><p>Sesuai gambar tersebut, terlihat orbital-orbital yang terlibat pada hibridisasi, yaitu 1 orbital s dan 3 orbital p, dimana dua orbital awal yang tidak berikatan dengan elektron dari H merupakan pasangan elektron bebas, sehingga hibridisasi senyawa H<sub>2</sub>O adalah sp<sup>3</sup>. </p><p> </p><p>Demikian pula untuk NH<sub>3</sub>, dimana atom pusat N tersedia 3 elektron tunggal pada subkulit 2p, masing-masing dapat berikatan dengan elektron dari H (ada 3 atom H yang berikatan dengan atom N). Perhatikan gambar terlampir, orbital-orbital yang terlibat pada hibridisasi, yaitu 1 orbital s dan 3 orbital p, maka hibridisasinya adalah sp<sup>3</sup>. </p><p> </p><p>Sama juga untuk molekul CH<sub>4</sub>, dimana ada 2 elektron tunggal pada subkulit 2p dan 1 orbital kosong. Sedangkan H yang akan berikatan ada 4, maka salah satu dari pasangan elektron pada 2s tereksitasi ke orbital 2p. Dengan demikian, 4 elektron H dapat berpasangan dengan masing-masing elektron tunggal dari C. Perhatikan gambar terlampir, orbital-orbital yang terlibat pada hibridisasi, yaitu 1 orbital s dan 3 orbital p, maka hibridisasinya adalah sp<sup>3</sup>. </p><p> </p><p>Jadi, orbital hibrida senyawa H<sub>2</sub>O, NH<sub>3</sub>, dan CH<sub>4</sub> adalah sp<sup>3</sup>.</p>
Hibridisasi dari H2O, NH3, dan CH4 adalah sp3.
Hibridisasi adalah peleburan orbital-orbital dari tingkat energi yang berbeda menjadi orbital-orbital yang energinya setingkat atau setara. Orbital yang dimaksud adalah orbital-orbital pada kulit terakhir atom yang berikatan. Untuk itu, perlu diketahui konfigurasi elektron H, O, N, dan C.
1H = 1s1 (elektron valensi: 1)
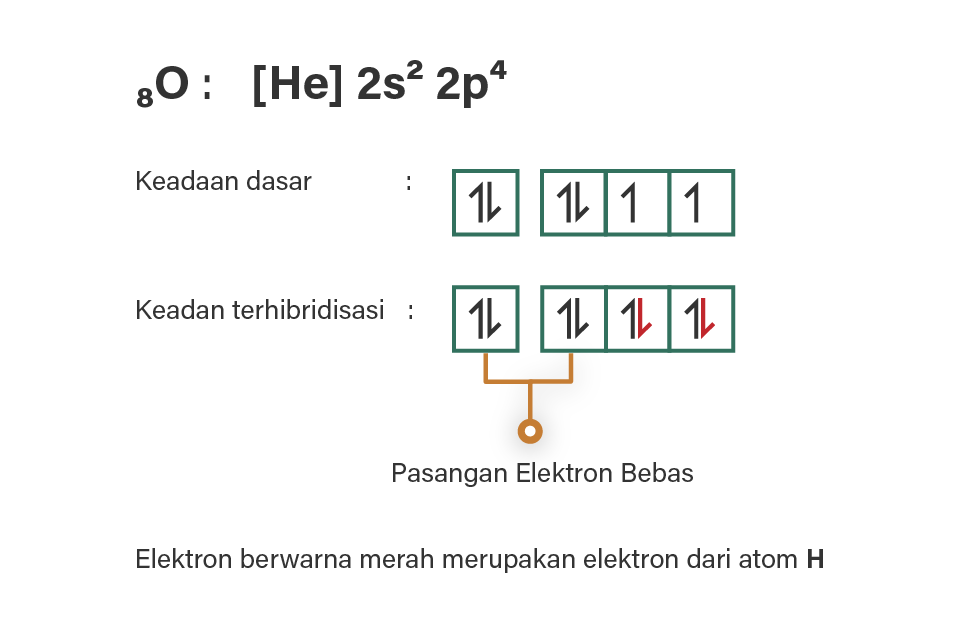
8O = [He] 2s2 2p4 (elektron valensi: 6)
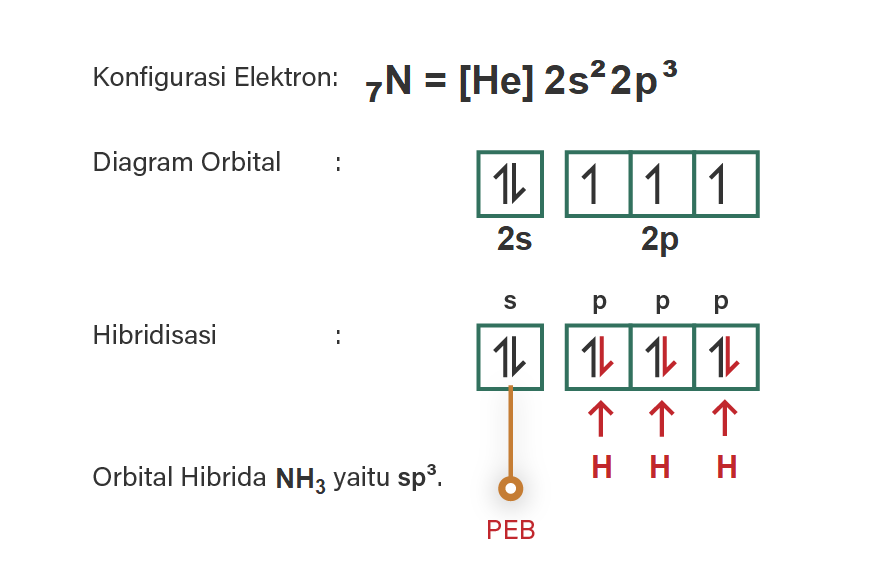
7N = [He] 2s2 2p3 (elektron valensi: 5)
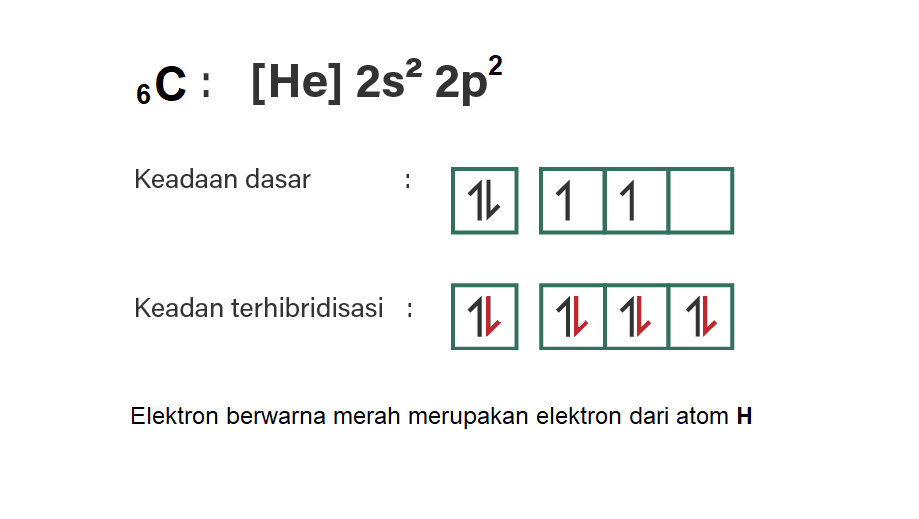
6C = [He] 2s2 2p2 (elektron valensi: 4)
Berdasarkan konfigurasi elektron tersebut, atom O memiliki elektron valensi yang berada pada 2s dan 2p (kulit 2). Pada keadaan dasar, 6 elektron terisi pada 2s dan 2p. Kemudian ada 2 atom H yang akan berikatan, dimana masing-masing atom H membutuhkan 1 elektron lagi agar stabil (duplet). Karena ada dua orbital yang sudah tersedia masing-masing dengan satu elektron, 2 atom H dapat berikatan dengan O, yaitu melalui masing-masing elektron tak berpasangan yang dimiliki O dan H. Perhatikan gambar terlampir.
Sesuai gambar tersebut, terlihat orbital-orbital yang terlibat pada hibridisasi, yaitu 1 orbital s dan 3 orbital p, dimana dua orbital awal yang tidak berikatan dengan elektron dari H merupakan pasangan elektron bebas, sehingga hibridisasi senyawa H2O adalah sp3.
Demikian pula untuk NH3, dimana atom pusat N tersedia 3 elektron tunggal pada subkulit 2p, masing-masing dapat berikatan dengan elektron dari H (ada 3 atom H yang berikatan dengan atom N). Perhatikan gambar terlampir, orbital-orbital yang terlibat pada hibridisasi, yaitu 1 orbital s dan 3 orbital p, maka hibridisasinya adalah sp3.
Sama juga untuk molekul CH4, dimana ada 2 elektron tunggal pada subkulit 2p dan 1 orbital kosong. Sedangkan H yang akan berikatan ada 4, maka salah satu dari pasangan elektron pada 2s tereksitasi ke orbital 2p. Dengan demikian, 4 elektron H dapat berpasangan dengan masing-masing elektron tunggal dari C. Perhatikan gambar terlampir, orbital-orbital yang terlibat pada hibridisasi, yaitu 1 orbital s dan 3 orbital p, maka hibridisasinya adalah sp3.
Jadi, orbital hibrida senyawa H2O, NH3, dan CH4 adalah sp3.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



