AC
Annisa C
11 Januari 2022 08:48
Iklan
AC
Annisa C
11 Januari 2022 08:48
Pertanyaan
Gunakan data energy ikatan untuk menghitung ΔH reaksi dari reaksi berikut b. C4H8(g) + HBr(g) → C4H9Br(g) C-C = 614 KJ/Mol C-H = 413 KJ/Mol C-C = 348 KJ/Mol C-CI = 328 KJ/Mol H-CI = 431 KJ/Mol C-Br = 276 KJ/Mol CI-CI = 242,7 KJ/Mol
17
1
Iklan
NA
N. Agnia
Mahasiswa/Alumni Institut Pertanian Bogor
26 Januari 2022 03:54
Jawaban terverifikasi
Halo Annisa, ΔH reaksi C₄H₈(g) + HBr(g) → C₄H₉Br(g) adalah -57 kJ/mol. Sedikit koreksi dan tambahan untuk data energi ikatan, yaitu D C=C = 614 kJ/mol, dan D H-Br = 366 kJ/mol. Perubahan entalpi (ΔH) suatu reaksi kimia menggambarkan jumlah kalor (energi) yang terlibat dalam suatu reaksi kimia. Jika diketahui energi ikatan rata-rata, nilai ΔH reaksi adalah: ΔH = energi pemutusan ikatan - energi pembentukan ikatan ΔH = ΣD pereaksi - ΣD produk Untuk reaksi C₄H₈(g) + HBr(g) → C₄H₉Br(g), reaksi lengkap dengan ikatannya diberikan pada gambar berikut yaa. Berikut perhitungan nilai ΔH reaksinya: ΔH = ΣD pereaksi - ΣD produk ΔH = [(8 x D C-H) + (2 x D C-C) + D C=C + D H-Br] - [(9 x D C-H) + (3 x D C-C) + D C-Br] ΔH = [D C=C + D H-Br] - [D C-H + D C-C + D C-Br] ΔH = [614 kJ/mol + 366 kJ/mol] - [413 kJ/mol + 348 kJ/mol + 276 kJ/mol] ΔH = 980 kJ/mol - 1.037 kJ/mol ΔH = -57 kJ/mol Tanda negatif (-) pada perubahan entalpi reaksi menunjukkan reaksi melepaskan kalor. Semoga bisa dipahami yaa :)
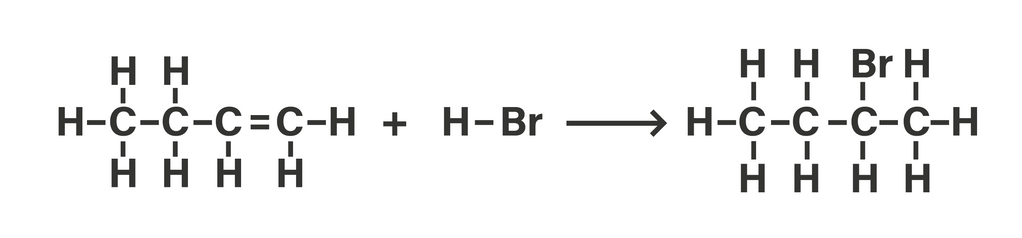
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



