EE
Esther E
12 Januari 2022 22:34
Iklan
EE
Esther E
12 Januari 2022 22:34
Pertanyaan
Gunakan data energi ikatan untuk menghitung perubahan entalpi reaksi dari reaksi berikut ! C3H6(g) + HBr(g) → C3H7Br(g)
4
2
Iklan
IS
I. Suci
Mahasiswa/Alumni Institut Pertanian Bogor
19 Januari 2022 14:34
Jawaban terverifikasi
Halo Esther, Kakak bantu jawab ya. Jadi perubahan entalpi reaksi dari reaksi tersebut adalah -322,7 kJ Perubahan entalpi reaksi dapat dihitung dengan mengurangkan jumlah energi ikatan rata-rata reaktan terhadap jumlah energi ikatan rata-rata produk, dirumuskan : ∆H = ∑(energi ikatan reaktan) – ∑(energi ikatan produk) Diketahui reaksinya adalah C3H6(g) + HBr(g) → C3H7Br(g) Karena data energi ikatannya tidak diketahui dalam soal, maka digunakan energi ikatan rata-rata berdasarkan literatur sebagai berikut : C-H : 413 kJ mol C-C : 358 kJ/mol H-Br = 366,3 kJ/mol C-Br: 276 kj/mol Untuk mempermudah, sebaiknya gambarkan terlebih dahulu struktur kimia dari masing-masing senyawa, sehingga terlihat jelas ikatan antar atomnya. Perubahan entalpinya dapat dihitung sebagai berikut. ∆H = ∑(energi ikatan reaktan) – ∑(energi ikatan produk) ∆H = ∑(2(C-C)+ 6(C-H)+ (H-Br)) - ∑(2(C-C)+ 7(C-H) +(C-Br)) ∆H = ∑(2(358) + 6(413) + 366,3) - ∑(2(358) + 7(413) + 276)) ∆H = ∑(716+2478+366,3) -∑(716+2891+276) ∆H =3560,3-3883 ∆H =-322,7 kJ
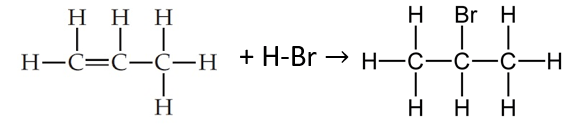
· 5.0 (1)
Iklan
HF
Hikmah F
18 November 2024 13:20
Gunakan data energi ikatan untuk menghitung reaksi dan reaksi berikut C4H8(g) HBr(g) C4H9Br(g)
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



