IN
Icha N
20 Desember 2021 01:48
Iklan
IN
Icha N
20 Desember 2021 01:48
Pertanyaan
Gambarkan struktur Lewis senyawa-senyawa berikut dan kelompokkan ke dalam senyawa ion atau senyawa kovalen! b. BeCl2
6
1
Iklan
AA
A. Atikasari
Mahasiswa/Alumni Universitas Negeri Yogyakarta
13 Januari 2022 14:25
Jawaban terverifikasi
Halo Icha, kakak bantu jawab pertanyaanmu yaa Senyawa BeCl₂ termasuk ke dalam senyawa kovalen, dengan struktur Lewis terlampir pada gambar. Ayo perhatikan penjelasan berikut, agar kamu lebih paham yaa ^^ Ikatan ion adalah ikatan yang terjadi antara atom logam dan atom non logam. Ikatan ion adalah gaya elektrostatis yang diakibatkan oleh transfer elektron dari logam ke non logam membentuk ion-ion yang bergabung bersama. Pada ikatan ionik, terjadi transfer elektron dari satu atom ke atom lainnya. Ikatan kovalen adalah ikatan yang terjadi antara dua atau lebih atom non logam dengan pemakaian elektron secara bersama. Struktur Lewis adalah diagram yang menunjukkan ikatan-ikatan antar atom dalam suatu molekul. Konfigurasi elektron unsur Be (logam) dan Cl (non logam) adalah sebagai berikut: ₄Be : 2 2 ₁₇Cl : 2 8 7 Senyawa BeCl₂ terdiri dari unsur logam dan non logam, tetapi BeCl₂ bukan senyawa ionik melainkan senyawa kovalen. Hal ini dapat terlihat dengan membandingkan sifat fisik senyawanya. Berilium klorida (BeCl₂) meleleh pada suhu 405 °C dan mendidih pada suhu 520°C. Sementara magnesium klorida memiliki titik leleh 714°C dan mendidih pada suhu 1412°C. Terlihat perbedaan yang besar pada kedua senyawa tersebut. Pada senyawayang mengandung ikatan ion terdapat interaksi elektrostatik yang kuat antara ion positif dan negatif sehingga senyawa tersebut memiliki titik didih yang tinggi. Karena titik didih BeCl₂ jauh lebih rendah, ini berarti bahwa berilium klorida mengandung ikatan kovalen. Berilium memiliki keelektronegatifan paling besar diantara logam golongan IIA lainnya. Keelektronegatifan merupakan kemampuan atom menarik elektron dari atom lain. Oleh sebab itu, berilium lebih cenderung menarik elektron daripada melepas elektron. Hal ini berbeda dengan unsur logam golongan IIA yang cenderung melepas elektron dan membentuk ion positif. Unsur ₄Be dilihat dari elektron valensinya yaitu 2, maka Be memiliki kecenderungan untuk dapat menarik 2 elektron (Be dalam senyawa BeCl₂ tidak memenuhi aturan oktet karena stabil hanya dengan 4 elektron). Unsur ₁₇Cl dilihat dari elektron valensinya yaitu 7, maka Cl memiliki kecenderungan untuk menarik 1 elektron agar stabil dengan elektron valensi 8. Ketika membentuk senyawa BeCl₂, maka atom Be akan mengikat 2 atom Cl, dan terjadi pemakaian elektron bersama. Oleh karena itu, senyawa BeCl₂ termasuk ke dalam senyawa kovalen karena terdapat ikatan kovalen di dalamnya, dengan struktur Lewis terlampir pada gambar di bawah ini:
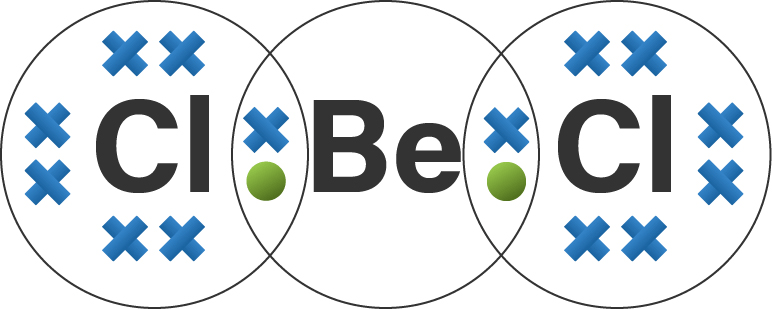
· 5.0 (2)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



