AA
Ana A
18 April 2022 15:02
Iklan
AA
Ana A
18 April 2022 15:02
Pertanyaan
gambarkan kurva titrasi untuk penambahan 15 ml larutan koh 0,1 m ke dalam 20 ml larutan hcl 0,05 m. tentukan ph sebelum titrasi, pada titik ekuivalen, dan pada akhir titrasi ketika semua basa telah ditambahkan. spesi apakah yang ada dalam larutan pada akhir titrasi?
2
1
Iklan
Q'
Q. 'Ainillana
Mahasiswa/Alumni Universitas Negeri Yogyakarta
29 April 2022 15:20
Jawaban terverifikasi
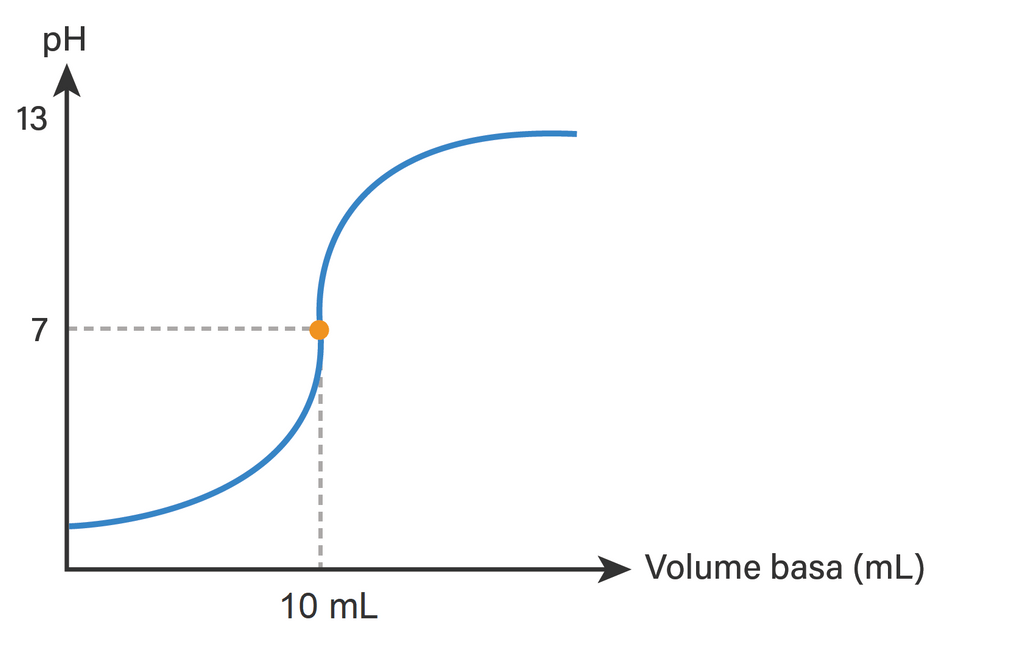
Halo Ana A, kurva titrasi dapat dilihat pada gambar terlampir, pH sebelum titrasi adalah 2 - log 5, pH saat titik ekuivalen adalah 7, dan pH di akhir titrasi adalah 12 + log 1,43, di akhir titrasi terdapat garam netral dan basa kuat KOH. Agar lebih jelas, simak pembahasan berikut yaa :) Titrasi adalah suatu prosedur yang digunakan untuk mengetahui konsentrasi suatu zat dengan cara mereaksikannya dengan sejumlah zat lain yang telah diketahui konsentrasinya. Pada soal ini, berarti dilakukan titrasi asam HCl (asam kuat) oleh basa kuat KOH (berdasarkan kalimat "penambahan 15 mL larutan KOH 0,1 M ke dalam 20 ml larutan HCl ..."). Dengan demikian, pH sebelum titrasi ditentukan oleh larutan HCl. Asam kuat HCl yang memiliki valensi (a) atau jumlah ion H+ adalah 1 dengan persamaan reaksi ionisasi berikut: HCl → H+ + Cl- Konsentrasi asam kuat dapat dicari dengan persamaan: [H+] = a x Ma [H+] = 1 x 0,05 [H+] = 5 x 10^-2 pH = - log [H+] pH = - log (5 x 10^-2) pH = 2 - log 5 Maka pH larutan sebelum titrasi adalah 2 - log 5. Selanjutnya penambahan KOH dilakukan hingga mencapai titik ekuivalen, yaitu titik dimana jumlah mol ekuivalen asam yang bereaksi sama dengan jumlah mol ekuivalen basa. Sehingga pH pada titik ekuivalen adalah sama dengan 7 (netral) karena pada kondisi ini terbentuk garam KCl yang tidak terhidrolisis. Untuk mengetahui mol basa yang bereaksi, kita perlu ketahui volume basa yang ditambahkan yang mencapai titik ekuivalen tersebut. Basa KOH merupakan basa kuat yang juga memiliki valensi (b) atau jumlah ion OH- adalah 1. Berikut persamaan reaksinya: KOH → K+ + OH- Pada titik ekuivalen berlaku persamaan berikut: a x Ma x Va = b x Mb x Vb 1 x 0,05 M x 20 mL = 1 x 0,1 M x Vb Vb = 10 mL Maka mol basa yang bereaksi sama dengan mol asam yang bereaksi yaitu: mol = M x V mol = 0,1 M x 10 mL = 1 mmol Sedangkan pada soal diketahui ada 15 mL larutan KOH 0,1 M yang digunakan, mol = M x V mol = 0,1 M x 15 mL mol = 1,5 mmol Persamaan reaksi mrs sesuai perhitungan tersebut dapat dilihat pada gambar terlampir. Di akhir reaksi terbentuk garam netral KCl dan bersisa basa kuat KOH sebanyak 1,5 mmol. Basa yang tersisa yang akan menentukan pH akhir titrasi. pH akhir titrasi adalah: [OH-] = b x Mb M basa diketahui dari mol sisa dibagi volume total (campuran), [OH-] = 1 x (0,5 mmol / 35 mL) [OH-] = 0,0143 M [OH-] = 1,43 x 10^-2 M pOH = - log [OH-] pOH = - log (1,43 x 10^-2) pOH = 2 - log 1,43 pH + pOH = 14 pH = 14 - (2 - log 1,43) pH = 12 + log 1,43 pH pada akhir titrasi adalah 12 + log 1,43. Dengan demikian, grafik dimulai dari pH dibawah 2 yang kemudian seiring bertambahnya volume KOH 0,1 M hingga volume KOH 10 mL tercapai titik akhir titrasi dengan pH = 7, kurva terus naik seiring penambahan volume dimana pada saat volume basa 15 mL, pH campuran berada di atas 12. Grafik titrasi dapat dilihat pada gambar terlampir. Jadi, kurva titrasi dapat dilihat pada gambar terlampir, pH sebelum titrasi adalah 2 - log 5, pH saat titik ekuivalen adalah 7, dan pH di akhir titrasi adalah 12 + log 1,43, di akhir titrasi terdapat garam netral dan basa kuat KOH. Terimakasih telah bertanya di Roboguru, semoga terbantu :D

· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



