IM
I M
29 Maret 2022 15:22
Iklan
IM
I M
29 Maret 2022 15:22
Pertanyaan
Dilakukan pencampuran 2 jenis larutan, yaitu 100 ml Ba(OH)2 XM dengan 200 ml larutan HF 0,3 M sehingga diperoleh campuran larutan dengan pH = 6- log 8. Jika diketahui Ka HF = 4 x 10‐⁶, maka pH larutan Ba (OH)2 adalah...
1
1
Iklan
YA
Y. Ayu
30 Maret 2022 05:56
Jawaban terverifikasi
Hai I M, kakak bantu jawab pertanyaanmu ya. Jawaban: pH = 13 + log 3 Ba(OH)2 merupakan basa kuat dan HF merupakan asam lemah. pH campuran tersebut adalah 6-log 8 yang artinya bersifat asam. Campuran tersebut dapat bersifat asam jika membentuk larutan penyangga asam. Larutan penyangga merupakan larutan yang mampu mempertahankan pH jika ditambahkan sedikit asam atau basa kuat dan penambahan air. Asam lemah berlebih jika ditambah oleh basa kuat akan membentuk larutan penyangga asam. Selain itu, larutan penyangga asam dapat dibuat dengan menambahkan basa konjugasinya ke dalam asam lemah. Rumus untuk menghitung pH larutan penyangga asam adalah: pH = -log [H+] = -log Ka x (mol asam/mol garam) Ba(OH)2 + 2HF → BaF2 + 2H2O Perbandingan mol asam HF dengan BaF2 adalah: pH = -log Ka x (mol asam/mol garam) 6 - log 8 = - log 4 x 10^-6 x (mol HF/mol BaF2) - log 8 x 10^-6 = - log 4 x 10^-6 x (mol HF/mol BaF2) 8 x 10^-6 = 4 x 10^-6 x (mol HF/mol BaF2) mol HF/mol BaF2 = 2 mol HF = 2 x mol BaF2 mol HF dan Ba(OH)2 awal adalah: n = M x V n HF = 0,3 M x 200 mL = 60 mmol n Ba(OH)2 = X M x 100 mL = 100X mmol Reaksi dan mol yang terlibat dapat dilihat pada gambar soal di lampiran. Dari reaksi tersebut, dapat diselesaikan menggunakan persamaan berikut: mol HF setimbang = 2 x mol BaF2 60 - 200X mmol = 2 x mol BaF2 mol BaF2 = 30 - 100X mmol 30 - 100X mmol = 100X mmol 30 = 200X mmol X = 0,15 mmol Jadi, mol Ba(OH)2 adalah: mol Ba(OH)2 = 100X = 100 x 0,15 mmol = 15 mmol Maka, konsentrasi Ba(OH)2 adalah: M = n/V = 15 mmol/100 mL = 0,15 M Rumus perhitungan pH basa kuat: [OH-] = x . Mb pOH = – log [OH-] pH = 14 - pOH keterangan: [OH-] = konsentrasi ion OH- x = valensi basa (jumlah ion OH-) Mb = molaritas basa Ba(OH)2 merupakan basa bervalensi 2, sehingga reaksi ionisasi dan konsentrasi OH- dari Ba(OH)2 adalah: Ba(OH)2 → Ba2+ + 2OH- [OH-] = x . M Ba(OH)2 [OH-] = 2 . 0,15 M [OH-] = 0,3 M = 3 x 10^-1 M pOH = – log [OH-] pOH = - log 3 x 10^-1 = 1 - log 3 pH = 14 - pOH pH = 14 - (1 - log 3) pH = 13 + log 3
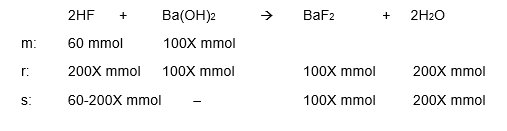
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



