Stephanus M
26 Juli 2022 15:46
Iklan
Stephanus M
26 Juli 2022 15:46
Pertanyaan
Diketahui reaksi: CO(g) + H2O(g)<--> CO2(g) + H2(g) tetapan kesetimbangan Kc = 0,1 . Mol CO yang harus ditambahkan pada 3 mol H2O agar menghasilkan 2 mol H2 adalah . . . . A. 42 mol B. 40 mol C. 22 mol D. 8 mol E. 4 mol
13
2
Iklan
A. Chusna
20 Agustus 2022 08:56
<p>Jawaban dari pertanyaan di atas adalah 42 mol. </p><p> </p><p>Tetapan Kesetimbangan (Kc) merupakan perbandingan antara hasil kali konsentrasi produk dipangkatkan dengan koefisien masing-masing dengan hasil kali antara konsentrasi reaktan dipangkatkan dengan koefisien masing-masing. Spesi yang dimasukkan dalam perhitungan nilai Kc ini hanyalah spesi yang memiliki fase (g) dan (aq) SAJA, sedangkan fase (s) dan (l) tidak ikut dalam perhitungan. Persamaan reaksi karbon monoksida dengan air adalah sebagai berikut. </p><p> </p><p>CO (g) + H₂O (g) ⇌ CO₂ (g) + H₂ (g)</p><p> </p><p>Tetapan kesetimbangan dari reaksi di atas adalah sebagai berikut. Kc = [CO₂].[H₂] / [CO].[H₂O] </p><p> </p><p>- Menentukan mol CO₂ yang terbentuk dan CO yang terurai </p><p>CO (g) + H₂O (g) --> CO₂ (g) + H₂ (g) </p><p>Perbandingan koefisien = perbandingan mol </p><p>Perbandingan koefisien CO₂ : H₂ = 1 : 1 </p><p>Jumlah mol CO₂ sebanding dengan jumlah mol H₂. </p><p> </p><p>n CO₂ = (koefisien CO₂/koefisien H₂) x mol H₂ </p><p>n CO₂ = (1/1) x 2 mol </p><p>n CO₂ = 2 mol </p><p> </p><p>n CO₂ yang terbentuk = n CO yang terurai n CO yang terurai = 2 mol (Dapat dilihat di gambar) </p><p> </p><p>- Menentukan [CO] </p><p>Jumlah mol yang digunakan untuk menentukan tetapan kesetimbangan adalah jumlah mol sisa (setelah terurai). Jika dimisalkan jumlah mol CO sisa adalah a mol maka jumlah mol CO mula-mula adalah a+2 mol. </p><p>(dapat dilihat di gambar) </p><p> </p><p>Jika volume masing-masing gas adalah 1 L maka [CO] dapat ditentukan seperti berikut ini. </p><p> </p><p>[CO₂] = 2 mol / 1 L = 2 M </p><p>[H₂] = 2 mol / 1 L = 2 M </p><p>[H₂O] = 1 mol / 1 L = 1M </p><p>[CO] = a mol / 1 L = aM </p><p> </p><p>- Menentukan nilai a </p><p>Kc = [CO₂].[H₂] / [CO].[H₂O] </p><p>0,1 = 2.2 / a.1 </p><p>0,1 a = 4 </p><p>a = 40 mol </p><p> </p><p>- Menentukan mol CO mula-mula </p><p>Jumlah mol CO mula-mula = a + 2 mol </p><p>Jumlah mol CO mula-mula = 40 + 2 = 42 mol </p><p> </p><p>Jadi jumlah mol yang harus ditambahkan adalah 42 mol.</p>
Jawaban dari pertanyaan di atas adalah 42 mol.
Tetapan Kesetimbangan (Kc) merupakan perbandingan antara hasil kali konsentrasi produk dipangkatkan dengan koefisien masing-masing dengan hasil kali antara konsentrasi reaktan dipangkatkan dengan koefisien masing-masing. Spesi yang dimasukkan dalam perhitungan nilai Kc ini hanyalah spesi yang memiliki fase (g) dan (aq) SAJA, sedangkan fase (s) dan (l) tidak ikut dalam perhitungan. Persamaan reaksi karbon monoksida dengan air adalah sebagai berikut.
CO (g) + H₂O (g) ⇌ CO₂ (g) + H₂ (g)
Tetapan kesetimbangan dari reaksi di atas adalah sebagai berikut. Kc = [CO₂].[H₂] / [CO].[H₂O]
- Menentukan mol CO₂ yang terbentuk dan CO yang terurai
CO (g) + H₂O (g) --> CO₂ (g) + H₂ (g)
Perbandingan koefisien = perbandingan mol
Perbandingan koefisien CO₂ : H₂ = 1 : 1
Jumlah mol CO₂ sebanding dengan jumlah mol H₂.
n CO₂ = (koefisien CO₂/koefisien H₂) x mol H₂
n CO₂ = (1/1) x 2 mol
n CO₂ = 2 mol
n CO₂ yang terbentuk = n CO yang terurai n CO yang terurai = 2 mol (Dapat dilihat di gambar)
- Menentukan [CO]
Jumlah mol yang digunakan untuk menentukan tetapan kesetimbangan adalah jumlah mol sisa (setelah terurai). Jika dimisalkan jumlah mol CO sisa adalah a mol maka jumlah mol CO mula-mula adalah a+2 mol.
(dapat dilihat di gambar)
Jika volume masing-masing gas adalah 1 L maka [CO] dapat ditentukan seperti berikut ini.
[CO₂] = 2 mol / 1 L = 2 M
[H₂] = 2 mol / 1 L = 2 M
[H₂O] = 1 mol / 1 L = 1M
[CO] = a mol / 1 L = aM
- Menentukan nilai a
Kc = [CO₂].[H₂] / [CO].[H₂O]
0,1 = 2.2 / a.1
0,1 a = 4
a = 40 mol
- Menentukan mol CO mula-mula
Jumlah mol CO mula-mula = a + 2 mol
Jumlah mol CO mula-mula = 40 + 2 = 42 mol
Jadi jumlah mol yang harus ditambahkan adalah 42 mol.
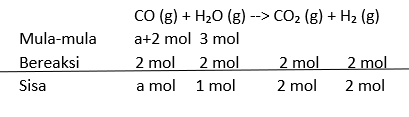
· 5.0 (1)
Iklan
Nur A
12 Maret 2023 19:21
Diketahui reaksi : CO (g) + H2O (g) CO2 (g) + H2 (g) tetapan kesetimbangan Kc = 0,1. Mol CO yang harus ditambahkan pada 3 mol H2O agar menghasilkan 2 mol H2 adalah…
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



