AA
Ana A
08 Mei 2022 15:36
Iklan
AA
Ana A
08 Mei 2022 15:36
Pertanyaan
Diketahui reaksi : 2 Na(s) + Cl2(g) Tentukan : → 2 NaCl(s) Tentukan a. reaksi oksidasi b. reaksi reduksi c. oksidator d. reduktor
5
1
Iklan
IY
I. Yassa
09 Mei 2022 02:49
Jawaban terverifikasi
Haloo kak ^^ Izin mengoreksi mungkin maksud kakak reaksinya adalah: 2Na(s) + Cl2(g) → 2NaCl(s) Jika demikian maka: a. Reaksi oksidasi: 2Na(s) → 2Na⁺(s) + 2e⁻ b. Reaksi reduksi: Cl2(g) + 2e⁻ → 2Cl⁻(s) c. Oksidator: Cl2 d. Reduktor: Na Sebelum menentukan reaksi oksidasi, reduksi, oksidator, dan reduktor hal yang harus dilakukan pertama adalah menentukan biloks dari unsur-unsur yang bereaksi. Berikut beberapa aturan yang berlaku dalam penentuan biloks: 1. Bilangan oksidasi unsur bebas dan netral adalah nol. 2. Bilangan oksidasi unsur logam selalu positif. 3. Golongan halogen memiliki bilangan oksidasi bermacam-macam namun pada umumnya adalah -1, kecuali Cl, Br, dan I jika berikatan dengan F atau O. Berdasarkan hal tersebut dapat diketahui bahwa: Pada ruas kiri: Biloks Na= 0 Biloks Cl pada Cl2= 0 Pada ruas kanan: NaCl → Na⁺ + Cl⁻ Biloks Na pada NaCl= +1 Biloks Cl pada NaCl= -1 (Lebih jelasnya dapat dilihat pada gambar terlampir) Dengan demikian reaksi oksidasi terjadi pada Na dari biloks 0 menjadi +1 (mengalami kenaikan) dengan reaksi: 2Na(s) → 2Na⁺(s) + 2e⁻ Sedangkan reaksi reduksi terjadi pada Cl dari biloks 0 menjadi -1 (mengalami penurunan) dengan reaksi: Cl2(g) + 2e⁻ → 2Cl⁻(s) Oksidator adalah spesi yang berperan menyebabkan spesi lain mengalami oksidasi, sedangkan reduktor adalah spesi yang berperan menyebabkan spesi lain mengalami reduksi. Dengan kata lain, oksidator adalah spesi yang mengalami reduksi dan reduktor adalah spesi yang mengalami oksidasi. Dengan demikian Na berperan sebagai reduktor dan Cl2 berperan sebagai oksidator. Jadi, pada reaksi soal dapat diketahui: a. Reaksi oksidasi: 2Na(s) → 2Na⁺(s) + 2e⁻ b. Reaksi reduksi: Cl2(g) + 2e⁻ → 2Cl⁻(s) c. Oksidator: Cl2 d. Reduktor: Na
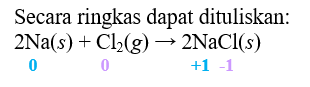
· 5.0 (1)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



