Asep K
12 Oktober 2023 15:52
Iklan
Asep K
12 Oktober 2023 15:52
Pertanyaan
diketahui persamaan reaksi: HCl(g) + NH3(g) --> NH4Cl (s). menurut Arrhenius, reaksi tersebut tidak dapat digolongkan reaksi asam-basa karena ...
3
1
Iklan
A. Anania
Mahasiswa/Alumni Hanyang University
07 November 2023 02:48
<p><strong>Jawaban yang tepat adalah karena tidak ada proses pelepasan OH- oleh senyawa NH3 dalam reaksi dan tidak terbentuknya H2O di akhir reaksi.</strong></p><p><br> </p><p><strong>Dalam ilmu kimia terdapat tiga teori tentang senyawa asam-basa, yaitu teori Arrhenius, teori Bronsted-Lowry dan teori Lewis. Menurut Arrhenius, asam adalah senyawa yang dapat melepaskan ion H+, sedangkan basa adalah senyawa yang dapat melepaskan ion OH-. Contoh senyawa asam menurut Arrhenius adalah HCl dengan reaksi sebagai berikut:</strong></p><p><strong>HCl → H+ + Cl-</strong></p><p><strong>Sedangkan contoh senyawa basa menurut Arrhenius adalah NaOH dengan reaksi sebagai berikut:</strong></p><p><strong>NaOH → Na+ + OH-</strong></p><p><br> </p><p><strong>Oleh karena itu, berdasarkan teori Arrhenius, reaksi asam-basa adalah reaksi dimana terjadi pelepasan H+ oleh asam dan OH- oleh basa menghasilkan garam dan air. Contohnya:</strong></p><p><strong>HCl + NaOH → NaCl + H2O</strong></p><p><br> </p><p><strong>Dalam soal diatas diketahui bahwa HCl bereaksi dengan NH3 menghasilkan NH4Cl. Jika dituliskan dalam bentuk setengah reaksi maka reaksinya adalah sebagai pada gambar di bawah ini. </strong></p><p><br> </p><p><strong>Jadi jelas terlihat bahwa meskipun HCl melepaskan ion H+ untuk berikatan dengan NH3 menghasilkan NH4Cl, namun senyawa NH3 tidak melepaskan ion OH-. Selain itu juga tidak terbentuk senyawa H2O sebagai produk reaksi. Oleh karena itu reaksi ini tidak dapat digolongkan sebagai reaksi asam-basa menurut Arrhenius. </strong></p><p><br> </p><p><strong>Jadi reaksi di atas bukan merupakan reaksi asam-basa menurut Arrhenius karena tidak ada proses pelepasan OH- oleh senyawa basa dalam reaksi dan tidak terbentuknya H2O di akhir reaksi.</strong></p><p><br> </p>
Jawaban yang tepat adalah karena tidak ada proses pelepasan OH- oleh senyawa NH3 dalam reaksi dan tidak terbentuknya H2O di akhir reaksi.
Dalam ilmu kimia terdapat tiga teori tentang senyawa asam-basa, yaitu teori Arrhenius, teori Bronsted-Lowry dan teori Lewis. Menurut Arrhenius, asam adalah senyawa yang dapat melepaskan ion H+, sedangkan basa adalah senyawa yang dapat melepaskan ion OH-. Contoh senyawa asam menurut Arrhenius adalah HCl dengan reaksi sebagai berikut:
HCl → H+ + Cl-
Sedangkan contoh senyawa basa menurut Arrhenius adalah NaOH dengan reaksi sebagai berikut:
NaOH → Na+ + OH-
Oleh karena itu, berdasarkan teori Arrhenius, reaksi asam-basa adalah reaksi dimana terjadi pelepasan H+ oleh asam dan OH- oleh basa menghasilkan garam dan air. Contohnya:
HCl + NaOH → NaCl + H2O
Dalam soal diatas diketahui bahwa HCl bereaksi dengan NH3 menghasilkan NH4Cl. Jika dituliskan dalam bentuk setengah reaksi maka reaksinya adalah sebagai pada gambar di bawah ini.
Jadi jelas terlihat bahwa meskipun HCl melepaskan ion H+ untuk berikatan dengan NH3 menghasilkan NH4Cl, namun senyawa NH3 tidak melepaskan ion OH-. Selain itu juga tidak terbentuk senyawa H2O sebagai produk reaksi. Oleh karena itu reaksi ini tidak dapat digolongkan sebagai reaksi asam-basa menurut Arrhenius.
Jadi reaksi di atas bukan merupakan reaksi asam-basa menurut Arrhenius karena tidak ada proses pelepasan OH- oleh senyawa basa dalam reaksi dan tidak terbentuknya H2O di akhir reaksi.
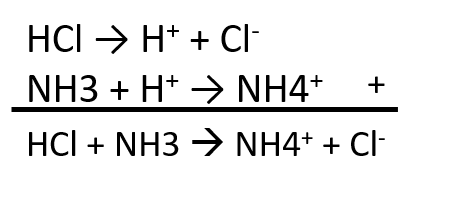
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



