AA
Ana A
14 Maret 2022 07:50
Iklan
AA
Ana A
14 Maret 2022 07:50
Pertanyaan
Diketahui P sel sebagai berikut. Cu2+(aq) + 2e → Cu(s) E° = +0,34 volt Fe3+(aq) + e → Fe2+(aq) E° = +0, 77 volt Sn4+(aq) + 2e→ Sn2+(aq) E° = +0, 15 volt Cr2O42-(aq) + 14H+(aq) + 6e → 2Cr3+(aq) + 7H2O(l) E° = + 1 ,33 volt Berdasarkan reaksi redoks berikut: 1) Cu(s)+ 2Fe3+(aq) → Cu2+(aq) + 2Fe2+(aq) 2) Sn2+(aq) + Cr2O72-(aq) → Sn4+(aq) + Cr3+(aq) Gambarlah susunan sel volta (tentukan anode dan katode, tunjukkan arah aliran elektron).
30
1
Iklan
FN
F. Nursanty
Mahasiswa/Alumni Universitas Diponegoro Semarang
19 Juli 2022 10:54
Jawaban terverifikasi
Jawaban dari soal tersebut adalah : 1. Anode adalah Fe ; katode adalah Cu; arah aliran elektron dar anode ke katode ( dari Fe ke Cu) 2. Anode adalah Sn; katode adalah Cr, arah aliran elektron dari anode ke katode (dari Sn ke Cr) Pembahasan Sel volta (sel galvani) adalah sel elektrokimia di mana energi kimia dari reaksi redoks spontan diubah menjadi energi listrik. Prinsip kerja sel volta dalam menghasilkan arus listrik adalah aliran transfer elektron dari reaksi oksidasi di anode ke reaksi reduksi di katode melalui rangkaian luar. Secara umum sel volta terdiri dari: • Anode: elektrode tempat terjadinya reaksi oksidasi. • Katode: elektrode tempat terjadinya reaksi reduksi. • Elektrolit: zat yang dapat menghantarkan listrik. • Rangkaian luar: kawat konduktor yang menghubungkan anode dengan katode. • Jembatan garam: rangkaian dalam yang terdiri dari larutan garam. Jembatan garam memungkinkan adanya aliran ion-ion dari setengah sel anode ke setengah sel katode, dan sebaliknya sehingga terbentuk rangkaian listrik tertutup. Pada reaksi pertama , logam Cu sebagai katode, karena mempunyai E sel lebih positif, sedangkan Fe sebagai anode, karena mempunyai Esel lebih negatif. Arah aliran elektron pada reaksi tersebut adalah dari anode ke katode, sehingga elektron bergerak dari logam Fe ke logam Cu. Pada reaksi kedua, logam Sn sebagai anode, karena mempunyai Esel lebih negatif, dan logam Cr sebagai katode, karena mempunyai E sel lebih positif. Arah aliran elektron pada reaksi tersebut adalah dari anode ke katode, sehingga elektron bergerak dari logam Sn ke logam Cr Dengan demikian keimpulannya adalah :. <=> Reaksi 1: Anode adalah Fe ; katode adalah Cu; arah aliran elektron dar anode ke katode ( dari Fe ke Cu) <=> Reaksi 2: Anode adalah Sn; katode adalah Cr, arah aliran elektron dari anode ke katode (dari Sn ke Cr) Gambar jembatan garam ada pa ilustrasi di bawah ini
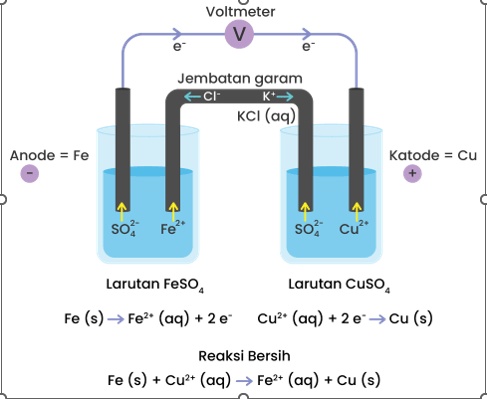
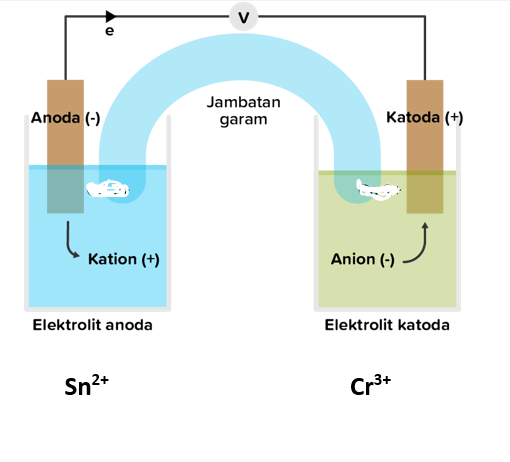
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



