Made K
15 Januari 2023 15:48
Iklan
Made K
15 Januari 2023 15:48
Pertanyaan
diketahui energi ikatan rata-rata berikut: reaksi berikut yang melepaskan kalor terbesar adalah .... a. 2nh3 --> n2 + 3h2 b. hcl --> 1/2 h2 + 1/2 cl2 c. co + 1/2 o2 --> co2 d. ch4 + 2o2 --> co2 + 2h2o e. 1/2 n2 + o2 --> no2
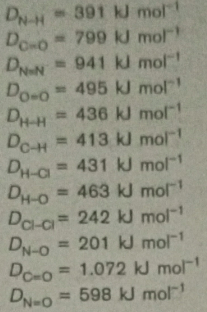
1
1
Iklan
Y. Frando
29 Januari 2023 19:51
<p>Jawaban yang benar adalah D. CH<sub>4</sub> + 2 O<sub>2</sub> --> CO<sub>2</sub> + 2 H<sub>2</sub>O.</p><p> </p><p>Diketahui:</p><p>Data energi ikatan rata-rata.</p><p>Ada ralat, harusnya D<sub>C≡O</sub> = 1.072 kJ/mol. </p><p> </p><p>Ditanya:</p><p>Reaksi yang melepaskan kalor terbesar = ...?</p><p> </p><p>Jawab:</p><p>Energi ikatan adalah energi yang diperlukan untuk memutuskan satu mol ikatan dari suatu molekul yang bewujud gas menjadi atom-atomnya. Jika energi yang dihasilkan untuk melepaskan kalor, maka artinya proses dalam keadaan eksoterm dimana nilai ΔH adalah negatif. Adapun ΔH untuk pemutusan atom-atom suatu reaksi dirumuskan oleh:</p><p>ΔH<sub>reaksi</sub> = ∑ ΔH<sub>reaktan</sub> - ∑ ΔH<sub>produk</sub>.</p><p> </p><p>Dari soal analisis energi masing-masing reaksi.</p><p>A. 2 NH<sub>3</sub> --> N<sub>2</sub> + 3 H<sub>2</sub>.</p><p>ΔH<sub>reaksi</sub> = (2 x (3 x D<sub>N-H</sub>)) - ((D<sub>N≡N</sub>) + (3 x D<sub>H-H</sub>))</p><p>ΔH<sub>reaksi</sub> = (6 x 391) - (941 + (3 x 436))</p><p>ΔH<sub>reaksi</sub> = +97 kJ/mol.</p><p> </p><p>B. HCl --> ½ H<sub>2</sub> + ½ Cl<sub>2</sub>.</p><p>ΔH<sub>reaksi</sub> = (D<sub>H-Cl</sub>) - ((½ x D<sub>H-H</sub>) + (½ x D<sub>Cl-Cl</sub>))</p><p>ΔH<sub>reaksi</sub> = (431) - ((½ x 436) + (½ x 242))</p><p>ΔH<sub>reaksi</sub> = +92 kJ/mol.</p><p> </p><p>C. CO + ½ O<sub>2</sub> --> CO<sub>2</sub>.</p><p>ΔH<sub>reaksi</sub> = ((D<sub>C≡O</sub>) + (½ x D<sub>O=O</sub>)) - (2 x D<sub>C=O</sub>)</p><p>ΔH<sub>reaksi</sub> = ((1.072) + (½ x 495)) - (2 x 799))</p><p>ΔH<sub>reaksi</sub> = -278,5 kJ/mol.</p><p> </p><p>D. CH<sub>4</sub> + 2 O<sub>2</sub> --> CO<sub>2</sub> + 2 H<sub>2</sub>O.</p><p>ΔH<sub>reaksi</sub> = ((4 x D<sub>C-H</sub>) + (2 x D<sub>O=O</sub>)) - ((2 x D<sub>C=O</sub>) + (2 x (2 x D<sub>H-O</sub>)))</p><p>ΔH<sub>reaksi</sub> = ((4 x 413) + (2 x 495)) - ((2 x 799) + (4 x 463))</p><p>ΔH<sub>reaksi</sub> = -808 kJ/mol.</p><p> </p><p>E. ½ N<sub>2</sub> + O<sub>2</sub> --> NO<sub>2</sub>.</p><p>ΔH<sub>reaksi</sub> = ((½ x D<sub>N≡N</sub>) + (D<sub>O=O</sub>)) - (D<sub>N-O</sub> + D<sub>N=O</sub>)</p><p>ΔH<sub>reaksi</sub> = ((½ x 941) + 495) - (201 + 598)</p><p>ΔH<sub>reaksi</sub> = +166,5 kJ/mol.</p><p> </p><p>Dari kelima hasil di atas, reaksi yang melepaskan kalor terbesar adalah reaksi yang memiliki nilai ΔH<sub>reaksi</sub> paling negatif. Maka, reaksinya adalah CH<sub>4</sub> + 2 O<sub>2</sub> --> CO<sub>2</sub> + 2 H<sub>2</sub>O dimana nilai ΔH<sub>reaksi</sub> nya sebesar -808 kJ/mol.</p><p> </p><p>Oleh karena itu, jawaban yang benar adalah D.</p>
Jawaban yang benar adalah D. CH4 + 2 O2 --> CO2 + 2 H2O.
Diketahui:
Data energi ikatan rata-rata.
Ada ralat, harusnya DC≡O = 1.072 kJ/mol.
Ditanya:
Reaksi yang melepaskan kalor terbesar = ...?
Jawab:
Energi ikatan adalah energi yang diperlukan untuk memutuskan satu mol ikatan dari suatu molekul yang bewujud gas menjadi atom-atomnya. Jika energi yang dihasilkan untuk melepaskan kalor, maka artinya proses dalam keadaan eksoterm dimana nilai ΔH adalah negatif. Adapun ΔH untuk pemutusan atom-atom suatu reaksi dirumuskan oleh:
ΔHreaksi = ∑ ΔHreaktan - ∑ ΔHproduk.
Dari soal analisis energi masing-masing reaksi.
A. 2 NH3 --> N2 + 3 H2.
ΔHreaksi = (2 x (3 x DN-H)) - ((DN≡N) + (3 x DH-H))
ΔHreaksi = (6 x 391) - (941 + (3 x 436))
ΔHreaksi = +97 kJ/mol.
B. HCl --> ½ H2 + ½ Cl2.
ΔHreaksi = (DH-Cl) - ((½ x DH-H) + (½ x DCl-Cl))
ΔHreaksi = (431) - ((½ x 436) + (½ x 242))
ΔHreaksi = +92 kJ/mol.
C. CO + ½ O2 --> CO2.
ΔHreaksi = ((DC≡O) + (½ x DO=O)) - (2 x DC=O)
ΔHreaksi = ((1.072) + (½ x 495)) - (2 x 799))
ΔHreaksi = -278,5 kJ/mol.
D. CH4 + 2 O2 --> CO2 + 2 H2O.
ΔHreaksi = ((4 x DC-H) + (2 x DO=O)) - ((2 x DC=O) + (2 x (2 x DH-O)))
ΔHreaksi = ((4 x 413) + (2 x 495)) - ((2 x 799) + (4 x 463))
ΔHreaksi = -808 kJ/mol.
E. ½ N2 + O2 --> NO2.
ΔHreaksi = ((½ x DN≡N) + (DO=O)) - (DN-O + DN=O)
ΔHreaksi = ((½ x 941) + 495) - (201 + 598)
ΔHreaksi = +166,5 kJ/mol.
Dari kelima hasil di atas, reaksi yang melepaskan kalor terbesar adalah reaksi yang memiliki nilai ΔHreaksi paling negatif. Maka, reaksinya adalah CH4 + 2 O2 --> CO2 + 2 H2O dimana nilai ΔHreaksi nya sebesar -808 kJ/mol.
Oleh karena itu, jawaban yang benar adalah D.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



