JM
Joko M
25 Januari 2022 14:17
Iklan
JM
Joko M
25 Januari 2022 14:17
Pertanyaan
Diketahui data percobaan sebagai berikut. Persamaan reaksi laju reaksi untuk percobaan di atas а. v = k [Br-] [H+] b. v = k [Br-]2 [H+]2 c. v = k [BrO3^- ] [H+] d. v = k [BrO3^-] [Br-] [H+] e. v = k [BrO3^-] [Br-] [H+]2
44
3
Iklan
CY
C. Yudha
Mahasiswa/Alumni Politeknik Negeri Bandung
30 Januari 2022 03:46
Jawaban terverifikasi
Halo Joko, jawaban yang paling tepat adalah opsi a. Ayo simak pembahasan berikut agar kamu lebih paham ya^_^ Laju reaksi adalah besarnya perubahan konsentrasi per satuan waktu. Konsentrasi reaktan akan berkurang per satuan waktu dan konsentrasi produk akan bertambah per satuan waktu. Orde reaksi merupakan tingkat reaksi suatu zat. yang menunjukan pengaruh konsentrasi suatu zat terhadap laju reaksi. Secara umum persamaan laju reaksi adalah sebagai berikut : v = k [A]^x [B]^y [C]^z dimana : v = laju reaksi k = tetapan laju reaksi x, y , z = orde reaksi Persamaan laju reaksi di atas dapat dituliskan sebagai berikut : v = k [BrO3-]^x [Br-]^y [H+]^z Laju reaksi (v) dapat dicari dengan 1/waktu. Pada soal diketahui data dalam waktu sehingga jika dalam laju reaksi adalah sebagai berikut : v data 1 = 1/80 = 0,0125 v data 2 = 1/40 = 0,025 v data 3 = 1/20 = 0,05 v data 4 = 1/10 = 0,1 - Menentukan orde reaksi terhadap H+ Untuk menentukan orde reaksi terhadap H+ maka supaya mengerjakannya mudah carilah data konsentrasi Br- dan BrO3- yang sama yaitu pada data nomor 2 dan 3 sehingga yang digunakan dalam perhitungan adalah data pada nomor 2 dan 3. Secara detail pengerjaan soal ini terlampir. - Menentukan orde reaksi terhadap Br- Untuk menentukan orde reaksi terhadap Br- maka supaya mengerjakannya mudah carilah data konsentrasi H+ dan BrO3- yang sama yaitu pada data nomor 1 dan 2 sehingga yang digunakan dalam perhitungan adalah data pada nomor 1 dan 2. Secara detail pengerjaan soal ini terlampir. - Menentukan orde reaksi terhadap BrO3- Karena orde reaksi terhadap H+ dan Br- sudah diketahui maka orde reaksi BrO3- dapat ditentukan dengan menggunakan data mana saja. Pada pembahasan ini menggunakan data nomor 1 dan 2. Secara detail pengerjaan soal ini terlampir. Karena orde reaksi BrO3- adalah nol maka tidak perlu dituliskan dalam persamaan laju reaksi. Berdasarkan perhitungan pada soal ini maka persamaan laju reaksi yang paling tepat adalah sesuai dengan opsi a yaitu v = k [Br-] [H+].

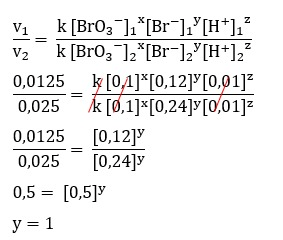
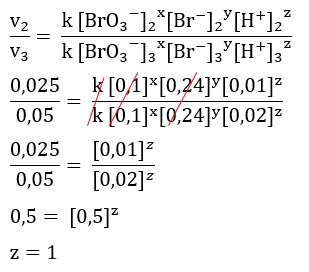
· 0.0 (0)
Iklan
WG
Wayan G
21 Maret 2024 00:13
Dalam bejana 3 liter, 5 mol gas amoniak terurai dengan derajad disosoasi 0,4 menurut reaksi: 2 NH₃ (g) ⇄ N₂ (g) + 3 H₂(g) Tekanan pada kesetimbangan adalah 3,5 atm. Maka harga tetapan Kp sebesar
· 0.0 (0)
WG
Wayan G
21 Maret 2024 00:14
Dalam bejana 3 liter, 5 mol gas amoniak terurai dengan derajad disosoasi 0,4 menurut reaksi: 2 NH₃ (g) ⇄ N₂ (g) + 3 H₂(g) Tekanan pada kesetimbangan adalah 3,5 atm. Maka harga tetapan Kp sebesar
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



