MK
Made K
15 Juli 2022 00:24
Iklan
MK
Made K
15 Juli 2022 00:24
Pertanyaan
dicampurkan 100 ml larutan CH3COOH 0,2 M dengan 100 ml NaOH 0,1 M(Ka=1×10^(−5)). Tentukan pH campuran!
4
2
Iklan
AT
A. Thoriq
Mahasiswa/Alumni Universitas Sriwijaya
24 Juli 2022 15:09
Jawaban terverifikasi
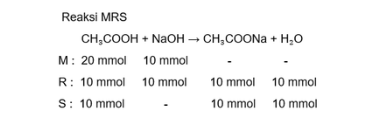
Jawaban yang benar adalah pH = 5. Larutan penyangga merupakan larutan yang bisa mempertahankan pH, jika ditambahka asam atau basa kuat. pH merupakan derajat keasaman yang digunakan untuk menyatakan tingkat keasaman atau kebasaan yang dimiliki suatu larutan. Menentukan mol zat n CH₃COOH = M x V n CH₃COOH = 0,2 M x 100 mL n CH₃COOH = 20 mmol n NaOH = M x V n NaOH =0,1 M x 100 mL n NaOH = 10 mmol Berdasarkan reaksi MRS, tersisa mol CH3COOH sebanyak10 mmol dan mol CH3COONa yang terbentuk adalah 10 mmol, sehingga mol basa konjugasinya dapat dihitung sebagai berikut: CH3COONa ==> CH3COO- + Na+ 10 mmol______10 mmol Dapat diketahui bahwa koefisien CH3COONa sama dengan koefisien CH3COO-, sehingga mol CH3COONa sama dengan mol CH3COO-, yaitu 10 mmol. Sehingga larutan penyangga bersifat asam. Menentukan konsentrasi H+ [H+] = Ka x mol CH3COOH sisa/mol CH3COO- [H+] = 1 x 10^-5 x 10 mmol/10 mmol [H+] = 10^-5 M Menentukan pH pH = - log [H+] pH = - log 10^-5 pH = 5 Dengan demikian, pH campuran adalah 5.
· 0.0 (0)
Iklan
AT
A. Thoriq
Mahasiswa/Alumni Universitas Sriwijaya
28 Juli 2022 13:41
Revisi kak
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



