VN
Via N
02 Maret 2022 15:41
Iklan
VN
Via N
02 Maret 2022 15:41
Pertanyaan
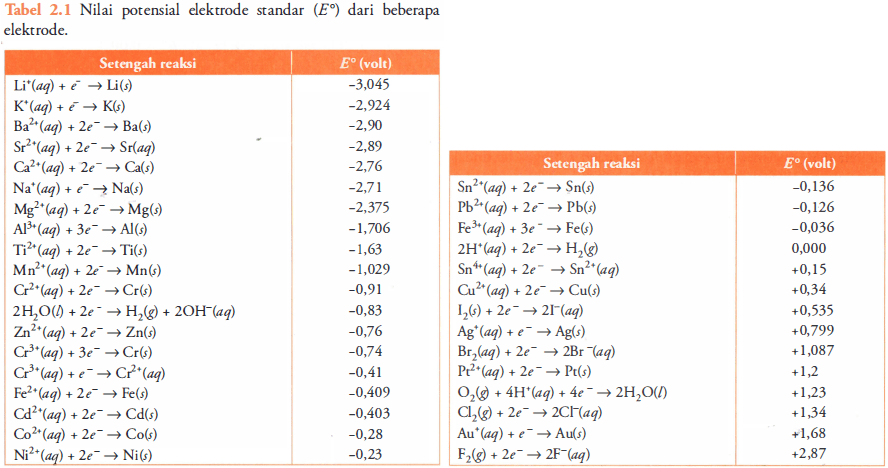
Dengan menggunakan data potensial elektrode standar pada Tabel 2.1, perkirakan apakah reaksi berikut dapat berlangsung spontan atau tidak spontan. c. Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
15
1
Iklan
GS
G. Suprobo
04 Maret 2022 05:55
Jawaban terverifikasi
Halo Via, Kakak bantu jawab ya. Jadi, reaksi Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g) dapat berlangsung spontan. Simak pembahasan berikut ya. Potensial sel yang diukur pada keadaan standar (suhu 25°C dengan konsentrasi setiap produk dan reaktan dalam larutan 1 M dan tekanan gas setiap produk dan reaktan 1 atm) disebut potensial sel standar (E°sel). Nilai potensial sel sama dengan selisih potensial kedua elektrode. Menurut kesepakatan, potensial elektrode standar mengacu pada potensial reaksi reduksi. E°sel = E°katode – E°anode Katode adalah elektrode yang memiliki nilai E° lebih besar (positif), sedangkan anode adalah elektrode yang memiliki nilai E° lebih kecil (negatif). Kespontanan reaksi redoks dapat diprediksi dari nilai potensial reaksi redoks tersebut. Nilai potensial reaksi redoks sama dengan nilai potensial sel, yaitu selisih antara potensial reduksi katode (reaksi reduksi) dengan potensial reduksi anode (reaksi oksidasi). Suatu reaksi redoks akan berlangsung spontan ke arah pembentukan produk bila potensial reaksinya bernilai positif. Redoks spontan: E°redoks > 0 Perhitungan: Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g) biloks Zn =0 biloks Zn pada ZnCl2=+2 Zn mengalami reaksi oksidasi karena terjadi peningkatan biloks Zn dari 0 menjadi +2. biloks H pada HCl=+1 biloks H2=0 HCl mengalami reaksi reduksi karena terjadi penurunan biloks H dari +1 menjadi 0. Menentukan kespontanan reaksi Berdasarkan tabel: 2H+ (aq) +2e → H2(aq) E° red (H+/H) =0,000 V Zn2+ (aq) +2e → Zn(s) E° red (Zn2+/Zn)=-0,76 V Reaksi reduksi di katode → E° lebih positif Reaksi oksidasi di anode → E° lebih negatif E° sel =E° katode (reduksi)-E° anode (oksidasi) E° sel =E° red (H+/H) - E° red (Zn2+/Zn) E° sel = 0,000 V -(-0,76 V)=+0,76 V (nilai E° sel positif) Dengan demikian, reaksi Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g) dapat berlangsung spontan.
· 3.0 (2)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



