CC
Cheryn C
14 Desember 2021 23:10
Iklan
CC
Cheryn C
14 Desember 2021 23:10
Pertanyaan
Data energi ikatan rata-rata : ✓C – C = 348 kJ/molC – H = 414 kJ/molC – O = 358 kJ/molO – H = 463 kJ/molO = O = 495 kJ/molC = O = 799 kJ/mol Gas etena dibakar dengan persamaan reaksi: Perubahan entalpi yang dihasilkan untuk pembakaran tersebut adalah ….
10
3
Iklan
DA
D. Aprilia
Mahasiswa/Alumni Universitas Pendidikan Indonesia
12 Januari 2022 16:25
Jawaban terverifikasi
Halo, Cheryn :) Sebelumnya kakak ijin koreksi yaa, karena persamaan reaksi pembakarannya tidak dicantumkan, jadi kakak tambahkan sesuai dengan reaksi pembakaran sempurna gas etena: C2H4 + 3O2 → 2CO2 + 2H2O sehingga perubahan entalpi (∆H) nya adalah −1273 kJ/mol. Agar lebih paham, simak pembahasannya dibawah ini! Reaksi kimia pada dasarnya terdiri dari dua proses, pertama adalah pemutusan ikatan antar-atom dari senyawa yang bereaksi (memerlukan kalor / endoterm), dan selanjutnya proses penggabungan ikatan kembali dari atom-atom yang terlibat reaksi sehingga membentuk susunan baru (membebaskan kalor / eksoterm). Energi ikatan rata-rata merupakan energi rata-rata yang diperlukan untuk memutuskan sebuah ikatan dari seluruh ikatan suatu molekul gas menjadi atom-atom gas. Nilai energi ikatan rata-rata dapat digunakan untuk memperkirakan nilai perubahan entalpi suatu reaksi. Perubahan entalpi merupakan selisih dari energi yang digunakan untuk memutuskan ikatan dengan energi yang terjadi dari penggabungan ikatan. ∆H = Σenergi ikatan pereaksi – Σenergi ikatan hasil reaksi ∆H = kiri – kanan Pertama, kita gambarkan dahulu struktur setiap zat untuk mengetahui ikatan yang terjadi. (perhatikan gambar dibawah) Selanjutnya, kita tentukan jumlah ikatan di ruas kiri dan kanan. Ruas kiri: C−H = ada 4 C=C = ada 1 O=O = ada 1 × koefisiennya 3 = 3 Ruas kanan: C=O = ada 2 × koefisiennya 2 = 4 O−H = ada 2 × koefisiennya 2 = 4 Lalu, masing-masing jumlah ikatan dikalikan dengan energi ikatan rata-rata dan dijumlahkan. (untuk energi ikatan C=C karena tidak ada dalam soal, jadi kakak tambahkan datanya sesuai data tabel energi ikatan yaitu 614 kJ/mol) Ruas kiri: C−H = 4 × 414 = 1656 C=C = 1 × 614 = 614 O=O = 3 × 495 = 1485 Jumlah = 3775 Ruas kanan: C=O = 4 × 799 = 3196 O−H = 4 × 463 = 1852 Jumlah = 5048 Langkah terakhir, kita hitung perubahan entalpi nya. ∆H = Σenergi ikatan pereaksi – Σenergi ikatan hasil reaksi ∆H = kiri – kanan ∆H = 3775 – 5048 ∆H = −1273 kJ/mol
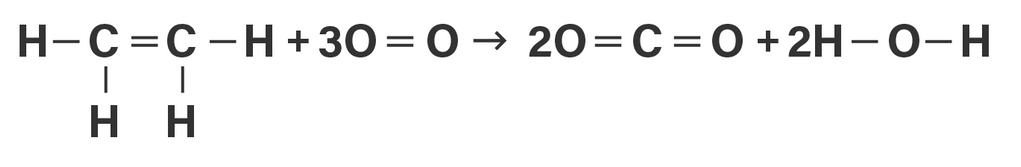
· 0.0 (0)
Iklan
MA
Muhamad A
08 Juni 2022 14:10
Perhatikan senyawa di bawah ini. Berdasarkan data yang ada tentukan biloks masing-masing unsur pada persamaan reaksi berikut? MgO, FeCl2, KMnO4, Na2SO4, AgNO3
· 0.0 (0)
MA
Muhamad A
08 Juni 2022 14:10
Perhatikan senyawa di bawah ini. Berdasarkan data yang ada tentukan biloks masing-masing unsur pada persamaan reaksi berikut? MgO, FeCl2, KMnO4, Na2SO4, AgNO3
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



