Via N
05 Januari 2023 07:17
Iklan
Via N
05 Januari 2023 07:17
Pertanyaan
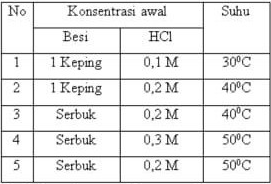
Dari data di atas, reaksi yang paling lambat adalah ... Data percobaan reaksi antara asam klorida dan besi sebagai berikut: a. 1 b. 2 c. 3 d. 4 e. 5
5
1
Iklan
A. Anania
Mahasiswa/Alumni Hanyang University
10 Januari 2023 08:58
<p><strong>Jawaban yang tepat adalah A. 1.</strong></p><p><br> </p><p><strong>Laju suatu reaksi kimia merupakan waktu yang diperlukan oleh suatu reaksi untuk menghasilkan produk. Terdapat beberapa faktor yang mempengaruhi laju reaksi:</strong></p><p><strong>- Area kontak antar reaktan. Makin besar area kontak antar reaktan, makin cepat reaksi terjadi. Cara untuk memperbesar area kontak adalah dengan memperkecil ukuran partikel dari reaktan.</strong></p><p><strong>- Konsentrasi reaktan. Makin besar konsentrasi reaktan makin cepat laju reaksinya. </strong></p><p><strong>- Suhu. Umumnya, makin tinggi suhu, makin cepat laju reaksinya.</strong></p><p><strong>- Katalis. Penambahan katalis akan mempercepat laju reaksi.</strong></p><p><br> </p><p><strong>Dalam percobaan reaksi asam klorida dengan besi, massa besi adalah tetap, namun dengan bentuk yang bervariasi, yaitu keping dan serbuk. Konsentrasi HCl juga divariasikan mulai dari 0,1 M, 0,2 M dan 0,3 M serta suhu percobaan mulai dari 30, 40 dan 50 derajat C.</strong></p><p><br> </p><p><strong>Reaksi yang berlangsung paling lambat adalah reaksi yang memiliki bentuk besi terbesar dengan konsentrasi HCl terkecil dan suhu yang terendah. Bentuk besi yang paling besar adalah bentuk kepingan. Sedangkan konsentrasi HCl yang paling kecil adalah 0,1 M dan suhu yang paling rendah adalah 30 derajat C. Jadi, diantara percobaan 1-5, yang memiliki bentuk besi berupa kepingan, konsentrasi HCl 0,1 M dan suhu percobaan 30 derajat C adalah percobaan nomor 1, sehingga percobaan tersebut memiliki laju reaksi paling rendah.</strong></p><p><br> </p><p><strong>Jadi, reaksi yang berlangsung paling lambat adalah A. 1.</strong></p><p><br> </p>
Jawaban yang tepat adalah A. 1.
Laju suatu reaksi kimia merupakan waktu yang diperlukan oleh suatu reaksi untuk menghasilkan produk. Terdapat beberapa faktor yang mempengaruhi laju reaksi:
- Area kontak antar reaktan. Makin besar area kontak antar reaktan, makin cepat reaksi terjadi. Cara untuk memperbesar area kontak adalah dengan memperkecil ukuran partikel dari reaktan.
- Konsentrasi reaktan. Makin besar konsentrasi reaktan makin cepat laju reaksinya.
- Suhu. Umumnya, makin tinggi suhu, makin cepat laju reaksinya.
- Katalis. Penambahan katalis akan mempercepat laju reaksi.
Dalam percobaan reaksi asam klorida dengan besi, massa besi adalah tetap, namun dengan bentuk yang bervariasi, yaitu keping dan serbuk. Konsentrasi HCl juga divariasikan mulai dari 0,1 M, 0,2 M dan 0,3 M serta suhu percobaan mulai dari 30, 40 dan 50 derajat C.
Reaksi yang berlangsung paling lambat adalah reaksi yang memiliki bentuk besi terbesar dengan konsentrasi HCl terkecil dan suhu yang terendah. Bentuk besi yang paling besar adalah bentuk kepingan. Sedangkan konsentrasi HCl yang paling kecil adalah 0,1 M dan suhu yang paling rendah adalah 30 derajat C. Jadi, diantara percobaan 1-5, yang memiliki bentuk besi berupa kepingan, konsentrasi HCl 0,1 M dan suhu percobaan 30 derajat C adalah percobaan nomor 1, sehingga percobaan tersebut memiliki laju reaksi paling rendah.
Jadi, reaksi yang berlangsung paling lambat adalah A. 1.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



