GS
Ghita S
15 Desember 2021 01:24
Iklan
GS
Ghita S
15 Desember 2021 01:24
Pertanyaan
Dalam wadah 1 liter terjadi kesetimbangan : 2SO3(g) ⬄ 2SO2(g) O2(g) . Jika mula – mula dimasukkan 1 mol SO3 ternyata saat setimbang jumlah mol SO3 sama dengan mol O2 , tentukan harga Kc!
11
1
Iklan
DA
D. Aprilia
Mahasiswa/Alumni Universitas Pendidikan Indonesia
13 Januari 2022 15:56
Jawaban terverifikasi
Halo Ghita :) Sebelumnya kakak ijin koreksi yaaa, di produk sepertinya kurang tanda “+” sehingga reaksi setimbangnya adalah 2SO₃(g) ⇌ 2SO₂(g) + O₂(g) . Jadi, harga Kc untuk reaksi tersebut yaitu 4/3. Agar lebih paham, yuk simak pembahasannya berikut ini! Reaksi kesetimbangan adalah reaksi reversible (dapat balik), artinya produk dapat bereaksi kembali membentuk reaktan. Reaksi kesetimbangan ditandai dengan lambang “⇌“ . Saat reaksi mencapai keadaan setimbang, kita dapat menentukan tetapan kesetimbangan (K). Berdasarkan konsentrasi, tetapan kesetimbangan dilambangkan dengan Kc. Untuk reaksi : aA + bB ⇌ cC + dD maka Kc nya (perhatikan gambar ke-1). Rumus Kc hanya berlaku untuk senyawa dengan fase gas (g) dan larutan (aq). Langkah-langkah untuk menentukan Kc: 1. Tuliskan reaksi setara 2SO₃(g) ⇌ 2SO₂(g) + O₂(g) 2. Tentukan mol saat setimbang menggunakan tabel m.r.s (mula-mula, reaksi, setimbang) (perhatikan tabel m.r.s pada lampiran gambar ke-2 dibawah) mol mula-mula SO3 = 1 mol (dituliskan di “m”). Kita misalkan mol yang bereaksi, “r”, nya adalah a mol untuk SO3 dan SO2 (karena koefisiennya sama, sedangkan untuk O2 mol yang bereaksinya ½ a mol. Sehingga didapat mol saat setimbangnya untuk SO3 adalah (1-a) mol, SO2 adalah a mol, dan O2 adalah ½ a mol. Diketahui pada keadaan setimbang mol SO3 sama dengan mol O2. mol SO3 = mol O2 1-a = ½ a 1 = ½ a + a 1 = 3/2 a a = 2/3 Kita substitusikan nilai a ke dalam masing-masing mol. SO3 = 1 – a mol SO3 = 1 – 2/3 mol SO3 = 1/3 mol SO2 = a mol SO2 = 2/3 mol O2 = ½ a mol O2 = ½ . 2/3 mol O2 = 1/3 mol 3. Hitung Molaritas setiap senyawa M = mol / Volume karena reaksi ini berlangsung dalam Volume 1 L, maka Molaritasnya sama dengan jumlah mol nya. SO3 dan O2 = 1/3 Molar SO2 = 2/3 Molar 4.Masukkan ke dalam rumus Kc 2SO₃(g) ⇌ 2SO₂(g) + O₂(g) ; semua fase nya gas maka dimasukkan ke dalam rumus. (perhatikan perhitungannya pada gambar ke-3)

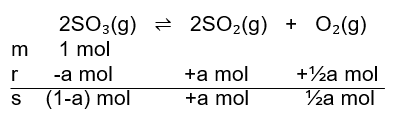
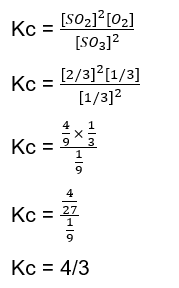
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



