TN
Trendztv N
11 Februari 2022 09:03
Iklan
TN
Trendztv N
11 Februari 2022 09:03
Pertanyaan
Dalam proses pemurnian tembaga dari bijihnya, logam tembaga tak murni, Cu, dilarutkan dalam asam sulfat untuk membentuk ion tembaga(II), Cu2+. Pastikan jika atom tembaga telah menjalani reduksi atau oksidasi atau bukan keduanya dan menggolongkannya sebagai Pereduksi, Oksidator atau bukan reaksi Redoks. A. Atom tembaga telah menjalani oksidasi dan dengan demikian Oksidator B. Atom tembaga telah menjalani reduksi dan dengan demikian Oksidator C. Atom tembaga tidak pernah menjalani oksidasi tidak juga reduksi, dengan demikian ini bukan reaksi Redoks D. Atom tembaga telah menjalani oksidasi dan dengan demikian Pereduksi E. Atom tembaga telah menjalani reduksi dan dengan demikian Pereduksi
2
2
Iklan
IA
I. Azalia
24 Februari 2022 15:10
Jawaban terverifikasi
Halo Trendztv, saya bantu jawab ya. jawaban yang tepat adalah D. Reaksi redoks adalah reaksi yang terdiri dari reaksi oksidasi dan reduksi. Berdasarkan perubahan bilangan oksidasinya, reaksi oksidasi adalah reaksi kenaikan bilangan oksidasi. Sedangkan reaksi reduksi adalah reaksi penurunan bilangan oksidasi. Zat yang mengalami oksidasi disebut reduktor, dan zat yang mengalami reduksi disebut oksidator. Untuk menentukan oksidator dan reduktor, maka tentukan perubahan biloksnya terlebih dahulut: Beberapa aturan Penentuan Biloks 1. Bilangan oksidasi ion sama dengan muatan ionnya 2. Jumlah biloks dalam senyawa sama dengan 0, sedangkan jumlah biloks dalam ion poliatom sama dengan muatan ionnya. 3. Biloks unsur-unsur golongan VII A (F, Cl, Br, I) dalam senyawa biner logam adalah -1 4. Biloks H jika berikatan dengan non logam sama dengan +1, sedangkan biloks H jika barikatan dengan logam dan boron adalah -1. 5. Biloks O dalam senyawa sama dengan -2, kecuali dalam senyawa biner fluorida, peroksida, dan superoksida. 6. Biloks golongan IA dalam senyawa sama dengan +1. Reaksi permunian tembaga dari bijihnya: Cu + H2SO4 → Cu2+ Logam Cu mengalami reaksi oksidasi, karena mengalami kenaikan bilangan oksidasi dari 0 pada Cu menjadi +2 pada Cu2+. Sehingga, logam Cu merupakan reduktor/pereduksi. Terimakasih sudah bertanya, semoga membantu ^_^
· 0.0 (0)
Iklan
NM
N. Malahayati
Mahasiswa/Alumni Universitas Syiah Kuala
15 Februari 2022 02:46
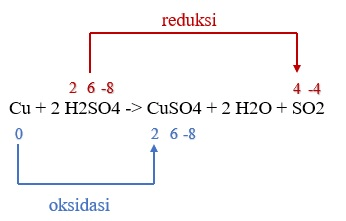
Halo Trendztv N, kakak bantu jawab yaa Jawaban yang benar adalah D. Atom tembaga telah menjalani oksidasi dan dengan demikian Pereduksi. Ayo simak pembahasan berikut agar kamu lebih paham ya Salah satu jenis dari reaksi kimia ada yang bernama reaksi redoks. Reaksi redoks merupakan reaksi reduksi dan reaksi oksidasi yang terjadi secara simultan. Nah dalam konsep reaksi redoks, terdapat beberapa cara untuk menentukan reaksi reduksi dan reaksi oksidasi yaitu konsep reaksi redoks berdasarkan pelepasan dan pengikatan oksigen, perpindahan (transfer) elektron, dan perubahan bilangan oksidasi (biloks). 1. Konsep Reaksi Redoks Berdasarkan Pelepasan dan Pengikatan Oksigen Reaksi redoks berdasarkan konsep ini menyatakan bahwa reaksi reduksi adalah reaksi yang mengalami pelepasan oksigen sementara untuk reaksi oksidasi adalah reaksi yang mengalami pengikatan oksigen. 2. Konsep Reaksi Redoks Berdasarkan Perpindahan (Transfer) Elektron Reaksi redoks berdasarkan konsep ini menyatakan bahwa reaksi reduksi adalah reaksi yang mengalami penangkapan elektron sementara untuk reaksi oksidasi adalah reaksi yang mengalami pelepasan elektron. 3. Konsep Reaksi Redoks Berdasarkan Perubahan Bilangan Oksidasi. Konsep reaksi redoks berdasarkan perubahan bilangan oksidasi menyatakan bahwa reaksi oksidasi adalah reaksi yang mengalami perubahan nilai bilangan oksidasi berupa kenaikan nilai bilangan oksidasi, sedangkan reaksi reduksi adalah reaksi yang mengalami perubahan nilai bilangan oksidasi berupa penurunan nilai bilangan oksidasi. Dengan demikian, reaksi pemurnian tembaga dari bijihnya adalah sebagai berikut sehingga dapat ditentukan merupakan reaksi redoks atau buka berdasarkan perubahan bilangan oksidasi: Cu + 2 H2SO4 -> CuSO4 + 2 H2O + SO2 Oksidasi: Atom Cu memiliki bilangan oksidasi 0 mengalami kenaikan bilangan oksidasi pada CuSO4 menjadi +2 sehingga Cu dapat dianggap sebagai reduktor. Reduksi: Atom S pada senyawa H2SO4 memiliki bilangan oksidasi +6 mengalami penurunan bilangan oksidasi pada SO2 menjadi +4 sehingga H2SO4 dapat dianggap sebagai oksidator. Reaksi ini dapat dianggap sebagai reaksi redoks dikarenakan terdapat reaksi oksidasi dan reaksi reduksi yang terjadi secara simultan. Terima kasih sudah bertanya, semoga bermanfaat. Terus gunakan Roboguru sebagai teman belajar kamu ya.
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



