LL
Lavoisier L
13 Januari 2023 10:18
Iklan
LL
Lavoisier L
13 Januari 2023 10:18
Pertanyaan
Campuran 50 ml 0,01 M Ba(OH)2 dan 150 ml HNO3 0,02 M akan menghasilkan pH sebesar...
1
1
Iklan
YY
Y. Yeni
Mahasiswa/Alumni Universitas Negeri Padang
08 Februari 2023 08:37
Jawaban terverifikasi
Jawaban: pH = 2 Pada reaksi asam dan basa Ba(OH)₂ + 2HNO₃ →Ba(NO₃)₂ + 2H₂O Mol Ba(OH)₂ = M x V = 0,01 M x 50 mL = 0,5 mmol Mol HNO₃ = M x V = 0,02 M x 150 mL = 3 mmol Mol Ba(OH)₂ lebih kecil sehingga habis bereaksi Mol HNO₃ bereaksi = koefisien HNO₃/ koefisien Ba(OH)₂ x mol Ba(OH)₂ = 2/1 x 0,5 mmol = 1 mmol mol HNO₃ sisa = mol HNO₃ awal - mol HNO₃ bereaksi = 3 mmol -1 mmol = 2 mmol Karena sisa HNO₃ yang merupakan asam kuat HNO₃ → H⁺ + NO₃⁻, a = 1 maka menentukan pH larutan berlaku [H⁺]= M x a =Mol/ volume total x a = 2 mmol/200 mL x 1 = 10⁻²M pH = - log [H⁺] = - log 10⁻²M = 2 Jadi, pH larutan adalah 2
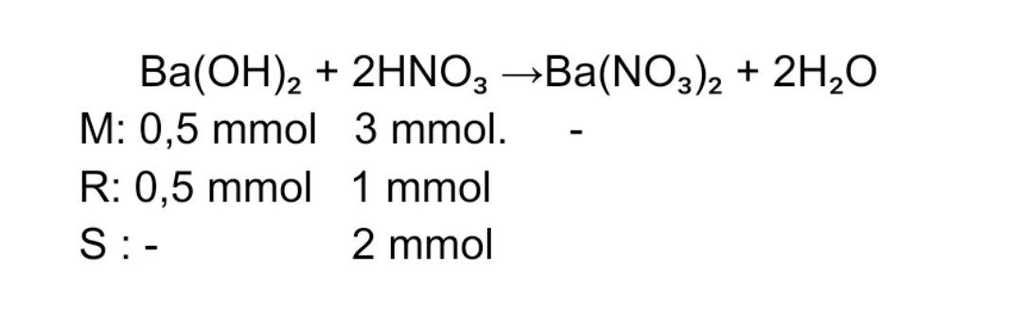
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



