Lavoisier L
13 Januari 2023 10:06
Iklan
Lavoisier L
13 Januari 2023 10:06
Pertanyaan
Berdasarkan reaksi berikut. 1. H2CO3 + H2O <===> H3O+ + HCO3- 2. HCO3- + H2O <===> H3O+ + CO32- 3. HCO3- + H2O <===> H2CO3 + OH- Dapat dikatakan bahwa ... 1. Asam H2CO3 mempunyai keasaman yang lebih besar daripada HCO3- 2. HCO3- bersifat amfoter 3. Ion CO32- merupakan basa konjugasi dari HCO3- 4. Pada reaksi nomer 3 diatas, H2O bersifat asam konjugasi darI OH-
7
1
Iklan
J. Siregar
Mahasiswa/Alumni Universitas Negeri Medan
23 Februari 2023 09:14
<p><strong><u>Jawaban yang benar adalah pernyatan 1-4 sesuai dengan reaksi.</u></strong></p><p> </p><p>Bronsted-Lowry mengemukakan teori asam-basa sebagai berikut.</p><ol><li>Asam merupakan zat yang melepaskan proton/donor proton. </li><li>Basa adalah zat yang menerima proton/akseptor proton.</li></ol><p>Setiap spesi asam (<strong>A</strong>) yang telah melepaskan proton ke basa (<strong>B</strong>) akan menghasilkan basa konjugasi (<strong>BK</strong>). Sebaliknya basa yang telah menerima proton dari asam akan menghasilkan asam konjugasi (<strong>AK</strong>). Suatu zat bersifat amfoter apabila dapat bertindak sebagai asam atau basa dengan cara melepaskan atau menerima proton.</p><p> </p><p>Reaksi bertahap dalam spesi H<sub>2</sub>CO<sub>3 </sub>terlampir pada gambar. Berdasarkan reaksi diatas dapat kita simpulkan bahwa:</p><p>1) Asam H<sub>2</sub>CO<sub>3</sub> mempunyai keasaman yang lebih besar daripada HCO<sub>3</sub><sup>-</sup> </p><p>2) Pada reaksi 2 dan 3, HCO<sub>3</sub><sup>-</sup> bersifat amfoter karena dapat bertindak sebagai donor dan akseptor proton.</p><p>3) CO<sub>3</sub><sup>2-</sup> merupakan basa konjugasi dari spesi asam HCO<sub>3</sub><sup>-</sup>.</p><p>4) Pada reaksi nomer 3 diatas, H<sub>2</sub>O bersifat asam konjugasi dari OH<sup>-</sup>.</p><p> </p><p>Dengan demikian, pernyataan 1), 2), 3), dan 4) sesuai dengan reaksi tersebut.</p>
Jawaban yang benar adalah pernyatan 1-4 sesuai dengan reaksi.
Bronsted-Lowry mengemukakan teori asam-basa sebagai berikut.
- Asam merupakan zat yang melepaskan proton/donor proton.
- Basa adalah zat yang menerima proton/akseptor proton.
Setiap spesi asam (A) yang telah melepaskan proton ke basa (B) akan menghasilkan basa konjugasi (BK). Sebaliknya basa yang telah menerima proton dari asam akan menghasilkan asam konjugasi (AK). Suatu zat bersifat amfoter apabila dapat bertindak sebagai asam atau basa dengan cara melepaskan atau menerima proton.
Reaksi bertahap dalam spesi H2CO3 terlampir pada gambar. Berdasarkan reaksi diatas dapat kita simpulkan bahwa:
1) Asam H2CO3 mempunyai keasaman yang lebih besar daripada HCO3-
2) Pada reaksi 2 dan 3, HCO3- bersifat amfoter karena dapat bertindak sebagai donor dan akseptor proton.
3) CO32- merupakan basa konjugasi dari spesi asam HCO3-.
4) Pada reaksi nomer 3 diatas, H2O bersifat asam konjugasi dari OH-.
Dengan demikian, pernyataan 1), 2), 3), dan 4) sesuai dengan reaksi tersebut.
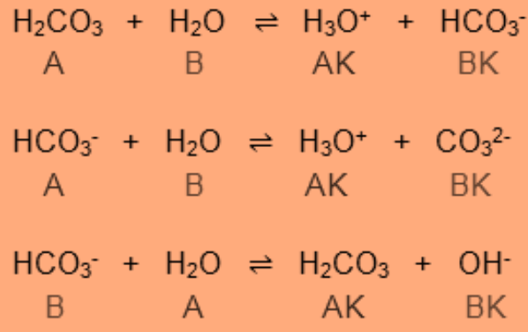
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



