Naufan N
11 Januari 2023 11:17
Iklan
Naufan N
11 Januari 2023 11:17
Pertanyaan
Berapa mL larutan NaOH 0,1 M harus dicampur dengan 100 mL larutan HCl 0,1 M untuk membuat larutan dengan pH = 3?
3
1
Iklan
Y. Frando
23 Juni 2023 06:14
<p>Jawaban yang benar adalah 98 mL.</p><p> </p><p>Diketahui:</p><p>[NaOH] = 0,1 M</p><p>[HCl] = 0,1 M</p><p>V HCl = 100 mL</p><p>pH = 3</p><p> </p><p>Ditanya:</p><p>Volume NaOH = ...?</p><p> </p><p>Jawab:</p><p>Larutan asam adalah larutan yang memiliki pH < 7.</p><p>Perhitungan pH sebagai berikut:</p><p>pH = -log [H+].</p><p> </p><p>Untuk asam kuat [H+] dapat dirumuskan dalam:</p><p>[H+] = n x [HA],</p><p> </p><p>dengan:</p><p>n = valensi asam</p><p>[HA] = konsentrasi asam kuat (M).</p><p> </p><p>Langkah pertama hitung mol HCl dengan cara berikut:</p><p>mol HCl = V × M</p><p>mol HCl = 100 mL × 0,1 M</p><p>mol HCl = 10 mmol.</p><p> </p><p>Misalkan volume NaOH = x, kemudian langkah kedua hitung mol yang bersisa dengan cara mula-mula, bereaksi, dan setimbang seperti pada gambar terlampir.</p><p>Karena yang bersisa adalah HCl maka larutan bersifat asam. hitung [H⁺] menggunakan rumus :</p><p>pH = 3 </p><p>- log [H⁺] = 3</p><p>[H⁺] = 10⁻³ M.</p><p> </p><p>Selanjutnya, hitung konsentrasi HCl menggunakan rumus :</p><p>[H⁺] = a × Ma</p><p>10⁻³ = 1 × Ma</p><p>Ma = 10⁻³ M</p><p>Ma = 0,001 M.</p><p> </p><p>Langkah terakhir, dari hasil di atas dapat dihitung volume NaOH dengan cara berikut:</p><p>M = mol/V</p><p>0,001 = (10 - 0,1x) / (100 + x)</p><p>0,001 (100 + x) = 10 - 0,1x</p><p>0,1 + 0,001x = 10 - 0,1x</p><p>0,001x + 0,1x = 10 - 0,1</p><p>0,101x = 9,9</p><p>x = 9,9/0,101</p><p>x = 98 mL.</p><p> </p><p>Jadi, volume larutan NaOH 0,1 M harus dicampur sebanyak 98 mL.</p>
Jawaban yang benar adalah 98 mL.
Diketahui:
[NaOH] = 0,1 M
[HCl] = 0,1 M
V HCl = 100 mL
pH = 3
Ditanya:
Volume NaOH = ...?
Jawab:
Larutan asam adalah larutan yang memiliki pH < 7.
Perhitungan pH sebagai berikut:
pH = -log [H+].
Untuk asam kuat [H+] dapat dirumuskan dalam:
[H+] = n x [HA],
dengan:
n = valensi asam
[HA] = konsentrasi asam kuat (M).
Langkah pertama hitung mol HCl dengan cara berikut:
mol HCl = V × M
mol HCl = 100 mL × 0,1 M
mol HCl = 10 mmol.
Misalkan volume NaOH = x, kemudian langkah kedua hitung mol yang bersisa dengan cara mula-mula, bereaksi, dan setimbang seperti pada gambar terlampir.
Karena yang bersisa adalah HCl maka larutan bersifat asam. hitung [H⁺] menggunakan rumus :
pH = 3
- log [H⁺] = 3
[H⁺] = 10⁻³ M.
Selanjutnya, hitung konsentrasi HCl menggunakan rumus :
[H⁺] = a × Ma
10⁻³ = 1 × Ma
Ma = 10⁻³ M
Ma = 0,001 M.
Langkah terakhir, dari hasil di atas dapat dihitung volume NaOH dengan cara berikut:
M = mol/V
0,001 = (10 - 0,1x) / (100 + x)
0,001 (100 + x) = 10 - 0,1x
0,1 + 0,001x = 10 - 0,1x
0,001x + 0,1x = 10 - 0,1
0,101x = 9,9
x = 9,9/0,101
x = 98 mL.
Jadi, volume larutan NaOH 0,1 M harus dicampur sebanyak 98 mL.
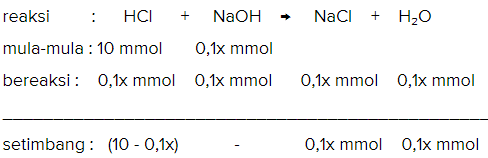
· 0.0 (0)
Keisha I
22 Januari 2025 15:29
halo kakak, pada reaksi mbs, kenapa bagian reaksinya bisa jadi 0.1x mmol ya kak ? terima kasih 🙏🏻
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



