DN
Desinta N
20 Oktober 2021 02:54
Iklan
DN
Desinta N
20 Oktober 2021 02:54
Pertanyaan
bagaimna penulisan lambang lewis untuk ion positif dan ion negatif? coba gambarkan lamang lewis ion ion berikut sn2+, k+, br-, s2-
8
3
Iklan
MI
M. Ilma
30 November 2021 06:55
Jawaban terverifikasi
Hai Desinta kakak bantu jawab yah Jawaban dari pertanyaan kamu adalah Penulisan lambang Lewis untuk ion positif dan ion negatif adalah diawali dengan menentukan elektron valensi atom netralnya kemudian, jika ion positif maka atom tersebut melepaskan sejumlah elekton sesuai muatan ionnya, jika ion negatif maka atom tersebut menangkap sejumlah elektron sesuai dengan muatan ionnya. Lambang struktur Lewis masing-masing ion sebagaimana gambar di bawah. Lambang Lewis merupakan menggambarkan cara penyusunan elektron valensi dalam suatu atom. Lambang Lewis untuk ion positif dan negatif mirip dengan lambang Lewis unsur netral, perbedaannya yaitu pada ion lambang Lewis dituliskan muatan ion tersebut. Konfigurasi elektron ion-ion pada soal sebagaimana berikut: Sn2+ : [Kr] 5s²4d¹⁰ elektron valensinya = 2 K+ : 1s² 2s² 2p⁶ 3s² 3p⁶ elektron valensinya = 8 Br- : [Ar] 4s² 3d¹⁰ 4p⁶ elektron valensinya = 8 S2- : [Ne] 3s² 3p⁶ elektron valensinya = 8 Lambang Lewis sebagaimana gambar di bawah.
· 0.0 (0)
Iklan
AH
A. Herlina
19 November 2021 11:42
Hallo Desinta, kakak bantu jawab ya😉 Konfigurasi elektron dan struktur lewisnya adalah:
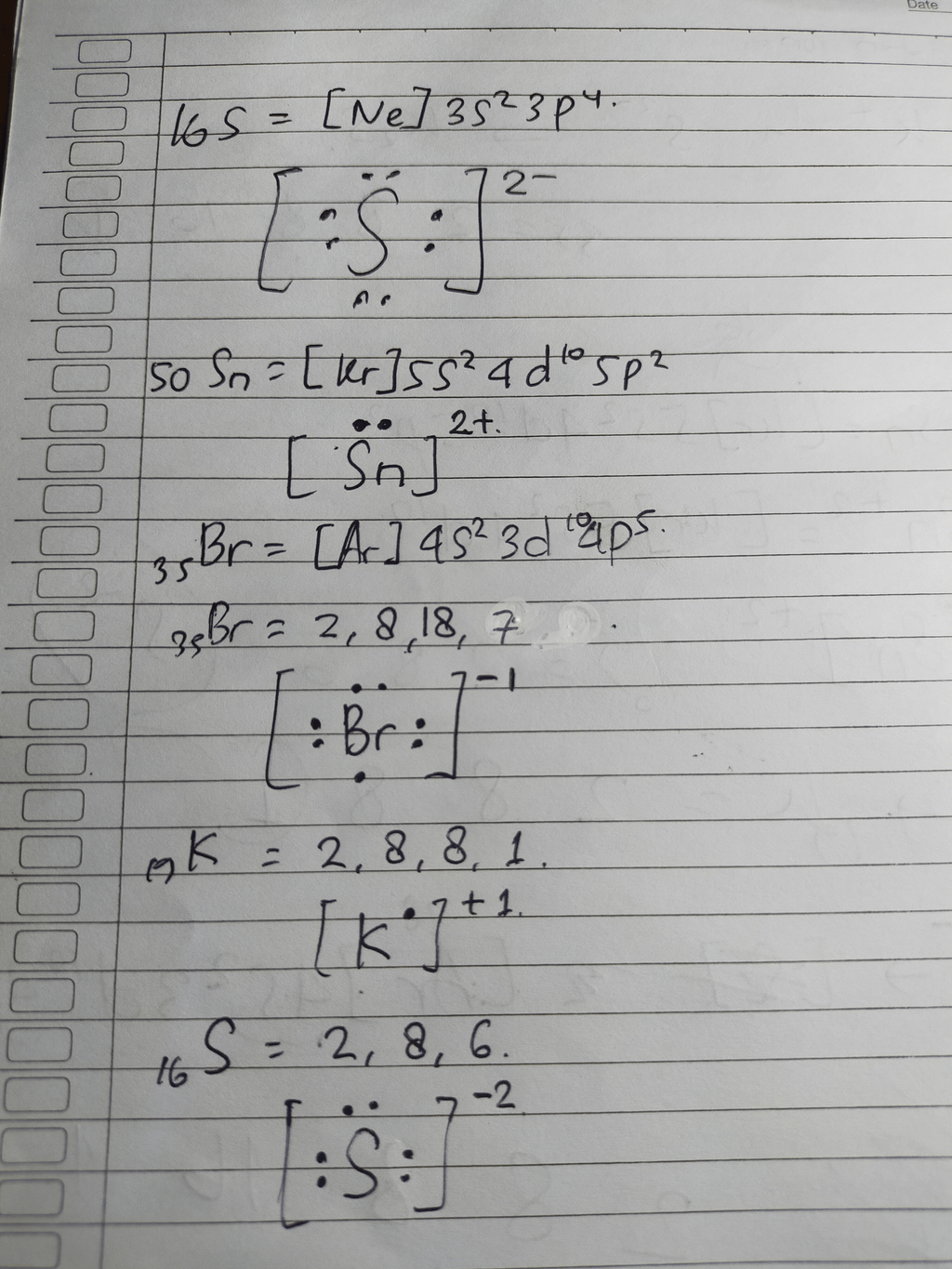
· 0.0 (0)
AH
A. Herlina
19 November 2021 11:55
Hallo Desinta, kakak bantu jawab ya😉 Konfigurasi elektron : 35Br = 2 8 18 7 Berdasarkan konfigurasi elektronnya, elektron valensi Brom adalah 7. Oleh karena itu, untuk mencapai kestabilan sesuai dengan aturan oktet (elektron valensi=8), maka Brom akan menangkap 1 elektron membentuk ion Br^- Konfigurasi eleltron : 19K = 2 8 8 1 Oleh karena itu, untuk mencapai kestabilan sesuai dengan aturan oktet (elektron valensi=8), maka Kalium akan melepaskan 1 elektron membentuk ion K+ Konfigurasi elektron : 16S = 2 8 6 Oleh karena itu, untuk mencapai kestabilan sesuai dengan aturan oktet (elektron valensi=8), maka Sulfur akan menangkap 2 elektron membentuk ion S^(-2) Konfigurasi elektron : 50Sn = [Kr] 5s^2 d^10 5p^2 Oleh karena itu, untuk mencapai kestabilan sesuai dengan aturan oktet (elektron valensi=8), maka Sn akan melepaskan 2 elektron membentuk ion Sn^(+2) Jadi pembentukan ion positif dan negatif serta struktur lewisnya busa diliat pada gambar berikut: Semoga bisa membantumu ya😉
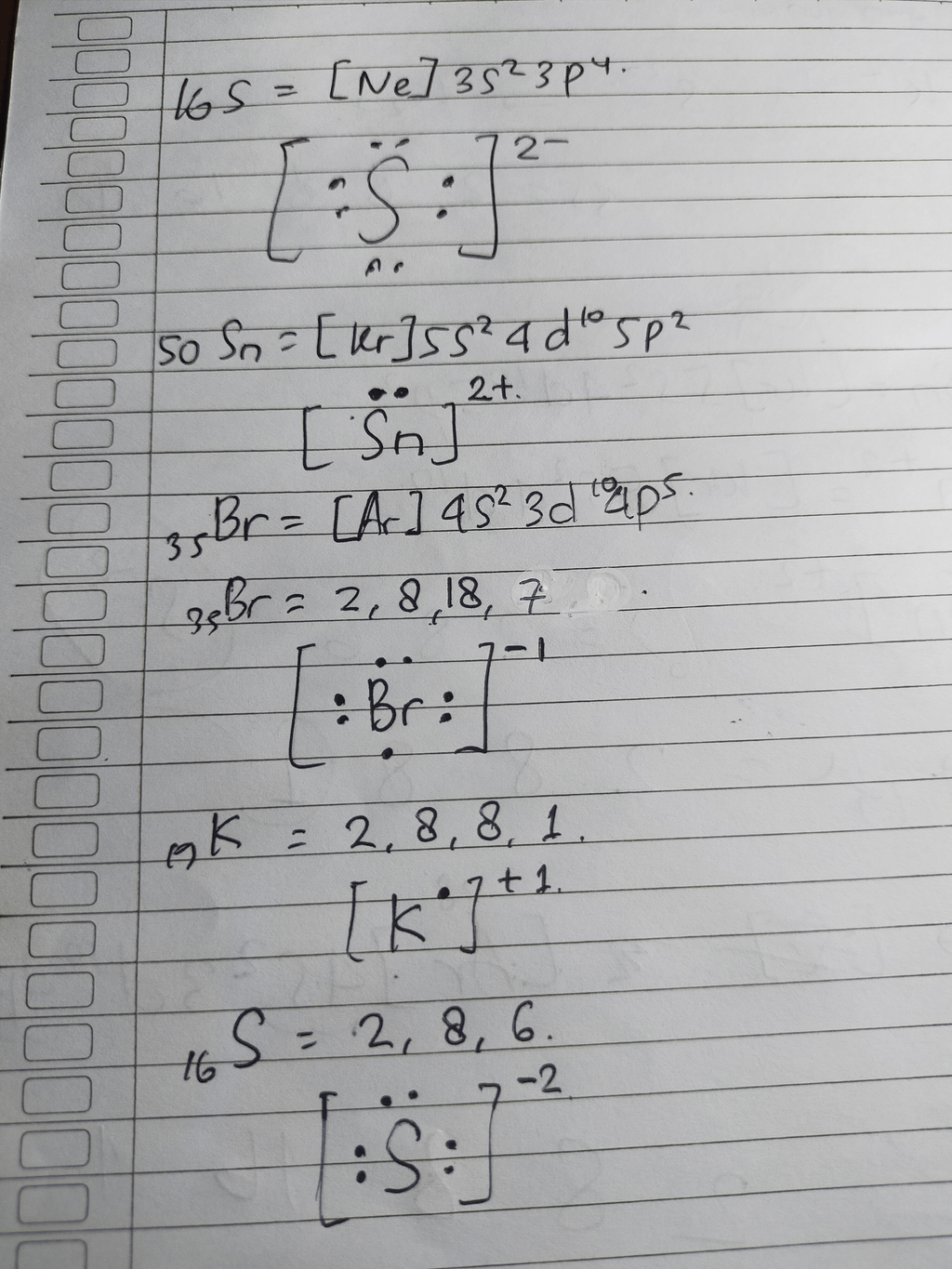
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



