OD
Olivia D
23 Juli 2022 11:49
Iklan
OD
Olivia D
23 Juli 2022 11:49
Pertanyaan
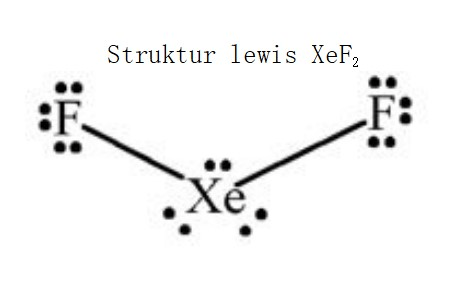
Atom Xe (nomor atom = 54) dan atom F (nomor atom = 9) membentuk senyawa XeF2. c. Berapa banyak pasangan elektron ikatan dan pasangan elektron bebas dalam senyawa tersebut?
9
1
Iklan
NI
N. Izzatun
Mahasiswa/Alumni Universitas Gadjah Mada
16 Agustus 2022 09:59
Jawaban terverifikasi
Jawabannya : senyawa XeF₂ memiliki 2 pasangan elektron ikatan (2 PEI) dan 3 pasangan elektron bebas di atom pusat (3 PEB). Pembahasan : PEI (pasangan elektron ikatan) adalah pasangan elektron yang berasal dari dua atom yang berbeda yang digunakan untuk berikatan, sedangkan PEB (pasangan elektron bebas) adalah pasangan elektron yang berasal dari atom yang sama dan tidak terikat atau bebas. Konfigurasi elektron ₅₄Xe = 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶ 4d¹⁰ 5S² 5P⁶ → terdapat 8 elektron valensi. Konfigurasi elektron ₉F = 1S² 2S² 2P⁵ → terdapat 7 elektron valensi. Atom F termasuk dalam golongan VIIA, sehingga untuk mencapai kestabilan oktet membutuhkan 1 elektron lagi. → perhatikan struktur lewis pada gambar terlampir. Dari struktur tersebut, senyawa XeF₂ memiliki 2 pasangan elektron ikatan (2 PEI) dan 3 pasangan elektron bebas di atom pusat (3 PEB). Jadi, senyawa XeF₂ memiliki 2 pasangan elektron ikatan (2 PEI) dan 3 pasangan elektron bebas di atom pusat (3 PEB).
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



