Ana A
10 Agustus 2022 04:23
Iklan
Ana A
10 Agustus 2022 04:23
Pertanyaan
8,4 gram NaHCO3 (Mr.84) dilarutkan dalam 100ml air akan mengalami hidrolisis sebagian dan memiliki ph……. (Ka1 H2CO3=10^(−5),ka2 H2CO3=10^(−11))
4
1
Iklan
A. Chusna
19 September 2022 08:16
<p>Jawaban dari pertanyaan di atas adalah 9,5.</p><p> </p><p>Hidrolisis garam adalah reaksi antara garam dengan air dan membentuk kesetimbangan. Garam yang dapat mengalami reaksi hidrolisis adalah garam – garam yang tersusun dari asam lemah atau basa lemah. Reaksi hidrolisis garam NaHCO<sub>3</sub> adalah sebagai berikut.</p><p> </p><p>HCO<sub>3<sup>-</sup></sub> (aq) + H<sub>2</sub>O (l) ⇌ H<sub>2</sub>CO<sub>3</sub> (aq) + OH<sup>-</sup> (aq)</p><p> </p><p>- Menentukan [HCO<sub>3<sup>-</sup></sub>]</p><p>n NaHCO<sub>3</sub> = massa NaHCO<sub>3 </sub> / Mr NaHCO<sub>3</sub></p><p>n NaHCO<sub>3 </sub>= 8,4 gram / 84 g/mol</p><p>n NaHCO<sub>3 </sub>= 0,1 mol</p><p> </p><p> [HCO<sub>3<sup>-</sup></sub>] = [NaHCO<sub>3</sub>] = n NaHCO<sub>3 </sub>/ volume NaHCO<sub>3</sub></p><p> [HCO<sub>3<sup>-</sup></sub>] = 0,1 mol / 0,1 L</p><p> [HCO<sub>3<sup>-</sup></sub>] = 1 M </p><p> </p><p>- Menentukan [OH-]</p><p>[OH-] = 10<sup>-4,5</sup></p><p>(perhitungan [OH-] terlampir di gambar)</p><p> </p><p>- Menentukan pH</p><p>pOH = - log [OH-]</p><p>pOH = - log 10<sup>-4,5</sup></p><p>pOH = 4,5</p><p>pH + pOH = 14</p><p>pH = 9,5 </p><p> </p><p>Jadi pH larutan adalah 9,5.</p>
Jawaban dari pertanyaan di atas adalah 9,5.
Hidrolisis garam adalah reaksi antara garam dengan air dan membentuk kesetimbangan. Garam yang dapat mengalami reaksi hidrolisis adalah garam – garam yang tersusun dari asam lemah atau basa lemah. Reaksi hidrolisis garam NaHCO3 adalah sebagai berikut.
HCO3- (aq) + H2O (l) ⇌ H2CO3 (aq) + OH- (aq)
- Menentukan [HCO3-]
n NaHCO3 = massa NaHCO3 / Mr NaHCO3
n NaHCO3 = 8,4 gram / 84 g/mol
n NaHCO3 = 0,1 mol
[HCO3-] = [NaHCO3] = n NaHCO3 / volume NaHCO3
[HCO3-] = 0,1 mol / 0,1 L
[HCO3-] = 1 M
- Menentukan [OH-]
[OH-] = 10-4,5
(perhitungan [OH-] terlampir di gambar)
- Menentukan pH
pOH = - log [OH-]
pOH = - log 10-4,5
pOH = 4,5
pH + pOH = 14
pH = 9,5
Jadi pH larutan adalah 9,5.
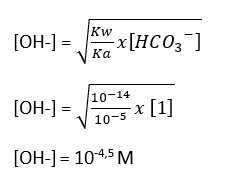
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



