NK
Nasywa K
15 Juni 2024 11:04
Iklan
NK
Nasywa K
15 Juni 2024 11:04
Pertanyaan
50 ml larutan CH3COOH 0,2 M (Ka 10 -5 ) dicampur dengan 50 ml larutan NaOH 0,2 M Berapakah pH larutan yang terjadi?
50 ml larutan CH3COOH 0,2 M (Ka 10-5) dicampur dengan 50 ml larutan NaOH 0,2 M Berapakah pH larutan yang terjadi?
3
2
Iklan
MS
Maria S
22 Juni 2024 04:02
Jawaban terverifikasi
<p>Karena garam terbentuk dari asam lemah dan basa kuat, maka garam bersifat basa.</p>
Karena garam terbentuk dari asam lemah dan basa kuat, maka garam bersifat basa.
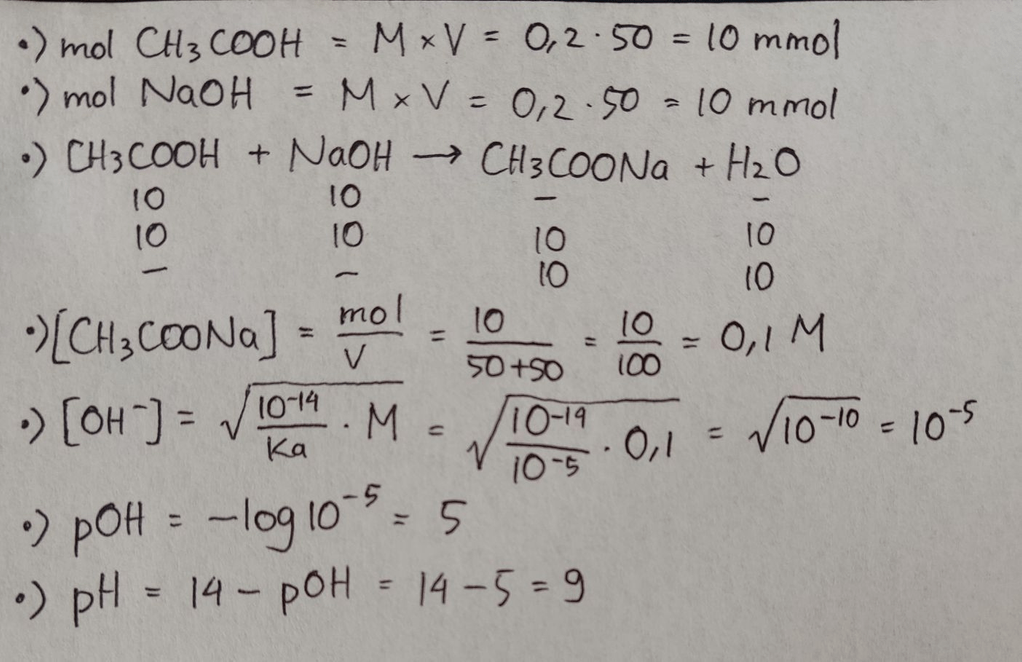
· 5.0 (1)
Iklan
KL
Kevin L

Gold
18 Juni 2024 12:39
Jawaban Langkah 1: Menghitung konsentrasi awal ion H+ dan OH- * Konsentrasi awal ion H+ Asam asetat (CH3COOH) adalah asam lemah dengan konstanta disosiasi asam (Ka) sebesar 10^-5. Ini berarti bahwa hanya sebagian kecil dari molekul asam asetat yang terdisosiasi menjadi ion H+ dan CH3COO-. Rumus untuk menghitung konsentrasi ion H+ dalam larutan asam lemah adalah: [H+] = √(Ka * [CH3COOH]) Di mana: * [H+] adalah konsentrasi ion H+ * Ka adalah konstanta disosiasi asam * [CH3COOH] adalah konsentrasi asam asetat Dalam kasus ini, Ka = 10^-5 dan [CH3COOH] = 0,2 M. [H+] = √(10^-5 * 0,2) = 1,41 x 10^-3 M * Konsentrasi awal ion OH- Natrium hidroksida (NaOH) adalah basa kuat yang terdisosiasi sempurna dalam air. Ini berarti bahwa setiap molekul NaOH terdisosiasi menjadi satu ion Na+ dan satu ion OH-. Rumus untuk menghitung konsentrasi ion OH- dalam larutan basa kuat adalah: [OH-] = [NaOH] Di mana: * [OH-] adalah konsentrasi ion OH- * [NaOH] adalah konsentrasi natrium hidroksida Dalam kasus ini, [NaOH] = 0,2 M. [OH-] = 0,2 M Langkah 2: Menghitung konsentrasi ion H+ dan OH- setelah pencampuran Ketika 50 ml larutan CH3COOH 0,2 M dicampur dengan 50 ml larutan NaOH 0,2 M, volume larutan campuran menjadi 100 ml. Konsentrasi ion H+ dan OH- setelah pencampuran dapat dihitung dengan rumus berikut: [H+] = [H+]awal * Vawal / Vtotal [OH-] = [OH-]awal * Vawal / Vtotal Di mana: * [H+]awal adalah konsentrasi ion H+ awal * [OH-]awal adalah konsentrasi ion OH- awal * Vawal adalah volume larutan awal * Vtotal adalah volume larutan total Dalam kasus ini, [H+]awal = 1,41 x 10^-3 M, [OH-]awal = 0,2 M, Vawal = 50 ml, dan Vtotal = 100 ml. [H+] = 1,41 x 10^-3 M * 50 ml / 100 ml = 7,05 x 10^-4 M [OH-] = 0,2 M * 50 ml / 100 ml = 0,1 M Langkah 3: Menghitung pH larutan pH larutan dapat dihitung dengan rumus berikut: pH = -log([H+]) Di mana: * pH adalah pH larutan * [H+] adalah konsentrasi ion H+ Dalam kasus ini, [H+] = 7,05 x 10^-4 M. pH = -log(7,05 x 10^-4) = 4,15 Kesimpulan pH larutan campuran adalah 4,15. Penjelasan * Larutan campuran bersifat basa karena konsentrasi ion OH- lebih tinggi daripada konsentrasi ion H+. * pH larutan campuran lebih tinggi daripada pH air murni (pH 7) karena larutan campuran mengandung ion OH- yang lebih banyak.
· 5.0 (1)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



