Arrhenius A
06 Januari 2023 04:23
Iklan
Arrhenius A
06 Januari 2023 04:23
Pertanyaan
2NO(g)+Cl2(g)⇌2NOCl(g) Di campurkan 0,4 mol gas NO dan 0,2 mol gas Cl2.Pada keadaan setimbang terdapat 0,2 mol NOCl pada tekanan 4 atm, tentukan harga Kp....
1
1
Iklan
Q. 'Ainillana
Mahasiswa/Alumni Universitas Negeri Yogyakarta
10 Januari 2023 06:02
<p>Harga Kp reaksi kesetimbangan tersebut adalah 1,25.</p><p> </p><p>Harga tetapan kesetimbangan tekanan (Kp) diketahui dari hasil kali tekanan parsial zat produk dibagi hasil kali tekanan parsial zat pereaksi dipangkatkan koefisien reaksi masing-masing.</p><p> </p><p>Sebelumnya tentukan terlebih dahulu mol zat yang terdapat saat keadaan setimbang. Perhatikan gambar terlampir.</p><p> </p><p>Kemudian, tentukan tekanan parsial masing-masing zat.</p><p> </p><p>P NO = mol NO / mol total x tekanan total</p><p>P NO = 0,2 / 0,5 x 4 atm</p><p>P NO = 1,6 atm</p><p> </p><p>P Cl2 = mol Cl2 / mol total x tekanan total</p><p>P Cl2 = 0,1 / 0,5 x 4 atm </p><p>P Cl2 = 0,8 atm</p><p> </p><p>P NOCl = mol NO / mol total x tekanan total</p><p>P NOCl = 0,2 / 0,5 x 4 atm</p><p>P NOCl = 1,6 atm</p><p> </p><p>Maka, nilai Kp dapat diperoleh,</p><p>Kp = (P NOCl)^2 / ((P NO)^2 x P Cl2))</p><p>Kp = (1,6)^2 / ((1,6)^2 x 0,8)</p><p>Kp = 1 / 0,8</p><p>Kp = 1,25</p><p> </p><p>Jadi, harga Kp reaksi kesetimbangan tersebut adalah 1,25.</p>
Harga Kp reaksi kesetimbangan tersebut adalah 1,25.
Harga tetapan kesetimbangan tekanan (Kp) diketahui dari hasil kali tekanan parsial zat produk dibagi hasil kali tekanan parsial zat pereaksi dipangkatkan koefisien reaksi masing-masing.
Sebelumnya tentukan terlebih dahulu mol zat yang terdapat saat keadaan setimbang. Perhatikan gambar terlampir.
Kemudian, tentukan tekanan parsial masing-masing zat.
P NO = mol NO / mol total x tekanan total
P NO = 0,2 / 0,5 x 4 atm
P NO = 1,6 atm
P Cl2 = mol Cl2 / mol total x tekanan total
P Cl2 = 0,1 / 0,5 x 4 atm
P Cl2 = 0,8 atm
P NOCl = mol NO / mol total x tekanan total
P NOCl = 0,2 / 0,5 x 4 atm
P NOCl = 1,6 atm
Maka, nilai Kp dapat diperoleh,
Kp = (P NOCl)^2 / ((P NO)^2 x P Cl2))
Kp = (1,6)^2 / ((1,6)^2 x 0,8)
Kp = 1 / 0,8
Kp = 1,25
Jadi, harga Kp reaksi kesetimbangan tersebut adalah 1,25.
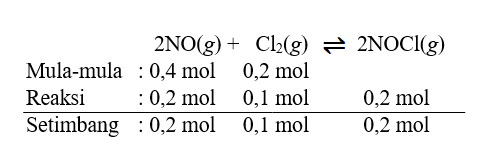
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



