Arrhenius A
06 Januari 2023 05:24
Iklan
Arrhenius A
06 Januari 2023 05:24
Pertanyaan
150 ml larutan CH3COOH 0,4 M (Ka= 10–5) direaksikan dengan 100 ml larutan NaOH 0,2 M. Untuk menetralkan kelebihan asam sehingga diperoleh : pH= 9 + 1/2 log 1,2, maka diperlukan 250 ml larutan Ba(OH)2....M a. 0,04 b. 0,08 c. 0,12 d. 0,16 e. 0,20
5
1
Iklan
A. Anania
Mahasiswa/Alumni Hanyang University
08 Februari 2023 03:42
<p><strong>Jawaban yang benar adalah A. 0,04 M.</strong></p><p><br> </p><p><strong>pH merupakan ukuran keasaman suatu larutan, yang dihitung dari berapa banyak konsentrasi ion H+ yang terdapat didalam larutan tersebut. Semakin kecil pH nya, semakin asam suatu larutan. Semakin besar pH nya, semakin basa suatu larutan. Pada saat larutan asam bercampur dengan larutan basa, maka akan terjadi reaksi netralisasi yaitu reaksi pembentukan garam. Reaksi umum untuk asam HA dan basa BOH menghasilkan garam BA adalah sebagai berikut:</strong></p><p><strong>HA + BOH → BA + H2O</strong></p><p><br> </p><p><strong>Pada soal diatas, CH3COOH bereaksi dengan NaOH sebagai berikut:</strong></p><p><strong>CH3COOH + NaOH → CH3COONa + H2O</strong></p><p><strong>Untuk mencari berapa kelebihan CH3COOH yang ada, maka kita perlu menghitung jumlah mol masing-masing reaktan.</strong></p><p><strong>Mol CH3COOH = Volume x Molaritas</strong></p><p><strong>Mol CH3COOH = 150 ml x 0,4 M</strong></p><p><strong>Mol CH3COOH = 60 mmol</strong></p><p><br> </p><p><strong>Mol NaOH = Volume x Molaritas</strong></p><p><strong>Mol NaOH = 100 ml x 0,2 M</strong></p><p><strong>Mol NaOH = 20 mmol</strong></p><p><br> </p><p><strong>Perhitungan mol-mol dalam reaksi dapat dilihat pada tabel dibawah ini:</strong></p><p><strong>Berdasarkan perhitungan tersebut, maka terdapat sisa CH3COOH sebesar 40 mmol. Diketahui bahwa sisa CH3COOH ini direaksikan dengan 250 ml Ba(OH)2 sehingga diperoleh pH 9+½ log 1,2. Reaksinya adalah sebagai berikut:</strong></p><p><strong>2 CH3COOH + Ba(OH)2 → Ba(CH3COO)2 + 2 H2O</strong></p><p><br> </p><p><strong>Jumlah mol Ba(OH)2 yang diperlukan untuk tepat bereaksi dengan CH3COOH adalah:</strong></p><p><strong>mol Ba(OH)2 = ½ x mol CH3COOH</strong></p><p><strong>mol Ba(OH)2 = ½ x 40 mmol</strong></p><p><strong>mol Ba(OH)2 = 20 mmol</strong></p><p><br> </p><p><strong>Kelebihan Ba(OH)2 kemudian membuat pH larutan menjadi basa, yaitu 9+½ log 1,2. Maka kita dapat mencari jumlah mol Ba(OH)2 yang diperlukan untuk menghasilkan pH tersebut.</strong></p><p><strong>pH = 14-pOH</strong></p><p><strong>(9+½ log 1,2) = 14 -pOH</strong></p><p><strong>pOH = 14 - 9,04</strong></p><p><strong>pOH = 4,96</strong></p><p><br> </p><p><strong>pOH = -log [OH-]</strong></p><p><strong>4,96 = -log [OH-]</strong></p><p><strong>[OH-] = 10^-4,96 mol/L</strong></p><p><br> </p><p><strong>Reaksi disosiasi dari Ba(OH)2 adalah : Ba(OH)2 → Ba2+ + 2 OH-</strong></p><p><strong>Maka konsentrasi Ba(OH)2 yang diperlukan adalah:</strong></p><p><strong>[Ba(OH)2] = ½ x [OH-]</strong></p><p><strong>[Ba(OH)2] = ½ x 10^-4,96 mol/L</strong></p><p><strong>[Ba(OH)2] = 5 . 10^-5,96 mol/L</strong></p><p><br> </p><p><strong>Karena diketahui volume Ba(OH)2 yang digunakan adalah 250 ml, maka total volume akhir campuran adalah:</strong></p><p><strong>Total volume = volume CH3COOH + volume NaOH + volume (Ba(OH)2</strong></p><p><strong>Total volume = 150 ml + 100 ml + 250 ml</strong></p><p><strong>Total volume = 500 ml</strong></p><p><br> </p><p><strong>Jadi mol BA(OH)2 yang diperlukan untuk menghasilkan pH 9+½ log 1,2 adalah:</strong></p><p><strong>Mol Ba(OH)2 = M x volume</strong></p><p><strong>Mol Ba(OH)2 = 5 . 10^-5,96 mol/L x 500 ml</strong></p><p><strong>Mol Ba(OH)2 = 0,002741 mmol</strong></p><p><br> </p><p><strong>Jadi, jumlah total mol Ba(OH)2 yang diperlukan untuk menetralkan sisa CH3COOH dan mengubah pH nya menjadi basa adalah:</strong></p><p><strong>Total mol Ba(OH)2 = mol Ba(OH)2 untuk menetralkan asam + mol Ba(OH)2 untuk mengubah pH</strong></p><p><strong>Total mol Ba(OH)2 = 20 mmol + 0,002741 mmol</strong></p><p><strong>Total mol Ba(OH)2 = 20,002741 mmol</strong></p><p><br> </p><p><strong>Konsentrasi Ba(OH)2 = total mol / volume total</strong></p><p><strong>Konsentrasi Ba(OH)2 = 20,002741 mmol / 500 ml</strong></p><p><strong>Konsentrasi Ba(OH)2 = 0,04 M</strong></p><p><br> </p><p><strong>Jadi untuk menghasilkan pH 9+½ log 1,2 dari campuran tersebut diperlukan 250 ml Ba(OH)2 dengan konsentrasi 0,04 M.</strong></p><p><br> </p>
Jawaban yang benar adalah A. 0,04 M.
pH merupakan ukuran keasaman suatu larutan, yang dihitung dari berapa banyak konsentrasi ion H+ yang terdapat didalam larutan tersebut. Semakin kecil pH nya, semakin asam suatu larutan. Semakin besar pH nya, semakin basa suatu larutan. Pada saat larutan asam bercampur dengan larutan basa, maka akan terjadi reaksi netralisasi yaitu reaksi pembentukan garam. Reaksi umum untuk asam HA dan basa BOH menghasilkan garam BA adalah sebagai berikut:
HA + BOH → BA + H2O
Pada soal diatas, CH3COOH bereaksi dengan NaOH sebagai berikut:
CH3COOH + NaOH → CH3COONa + H2O
Untuk mencari berapa kelebihan CH3COOH yang ada, maka kita perlu menghitung jumlah mol masing-masing reaktan.
Mol CH3COOH = Volume x Molaritas
Mol CH3COOH = 150 ml x 0,4 M
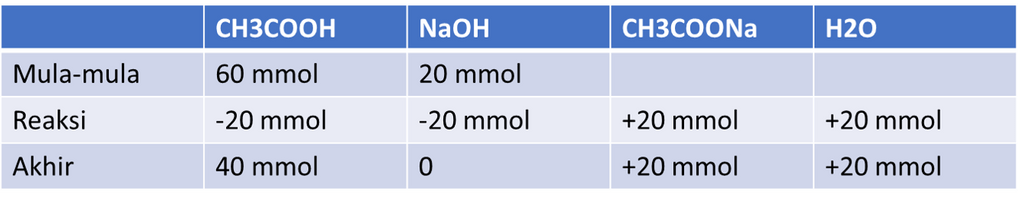
Mol CH3COOH = 60 mmol
Mol NaOH = Volume x Molaritas
Mol NaOH = 100 ml x 0,2 M
Mol NaOH = 20 mmol
Perhitungan mol-mol dalam reaksi dapat dilihat pada tabel dibawah ini:
Berdasarkan perhitungan tersebut, maka terdapat sisa CH3COOH sebesar 40 mmol. Diketahui bahwa sisa CH3COOH ini direaksikan dengan 250 ml Ba(OH)2 sehingga diperoleh pH 9+½ log 1,2. Reaksinya adalah sebagai berikut:
2 CH3COOH + Ba(OH)2 → Ba(CH3COO)2 + 2 H2O
Jumlah mol Ba(OH)2 yang diperlukan untuk tepat bereaksi dengan CH3COOH adalah:
mol Ba(OH)2 = ½ x mol CH3COOH
mol Ba(OH)2 = ½ x 40 mmol
mol Ba(OH)2 = 20 mmol
Kelebihan Ba(OH)2 kemudian membuat pH larutan menjadi basa, yaitu 9+½ log 1,2. Maka kita dapat mencari jumlah mol Ba(OH)2 yang diperlukan untuk menghasilkan pH tersebut.
pH = 14-pOH
(9+½ log 1,2) = 14 -pOH
pOH = 14 - 9,04
pOH = 4,96
pOH = -log [OH-]
4,96 = -log [OH-]
[OH-] = 10^-4,96 mol/L
Reaksi disosiasi dari Ba(OH)2 adalah : Ba(OH)2 → Ba2+ + 2 OH-
Maka konsentrasi Ba(OH)2 yang diperlukan adalah:
[Ba(OH)2] = ½ x [OH-]
[Ba(OH)2] = ½ x 10^-4,96 mol/L
[Ba(OH)2] = 5 . 10^-5,96 mol/L
Karena diketahui volume Ba(OH)2 yang digunakan adalah 250 ml, maka total volume akhir campuran adalah:
Total volume = volume CH3COOH + volume NaOH + volume (Ba(OH)2
Total volume = 150 ml + 100 ml + 250 ml
Total volume = 500 ml
Jadi mol BA(OH)2 yang diperlukan untuk menghasilkan pH 9+½ log 1,2 adalah:
Mol Ba(OH)2 = M x volume
Mol Ba(OH)2 = 5 . 10^-5,96 mol/L x 500 ml
Mol Ba(OH)2 = 0,002741 mmol
Jadi, jumlah total mol Ba(OH)2 yang diperlukan untuk menetralkan sisa CH3COOH dan mengubah pH nya menjadi basa adalah:
Total mol Ba(OH)2 = mol Ba(OH)2 untuk menetralkan asam + mol Ba(OH)2 untuk mengubah pH
Total mol Ba(OH)2 = 20 mmol + 0,002741 mmol
Total mol Ba(OH)2 = 20,002741 mmol
Konsentrasi Ba(OH)2 = total mol / volume total
Konsentrasi Ba(OH)2 = 20,002741 mmol / 500 ml
Konsentrasi Ba(OH)2 = 0,04 M
Jadi untuk menghasilkan pH 9+½ log 1,2 dari campuran tersebut diperlukan 250 ml Ba(OH)2 dengan konsentrasi 0,04 M.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



