Dalton D
13 Januari 2023 10:07
Iklan
Dalton D
13 Januari 2023 10:07
Pertanyaan
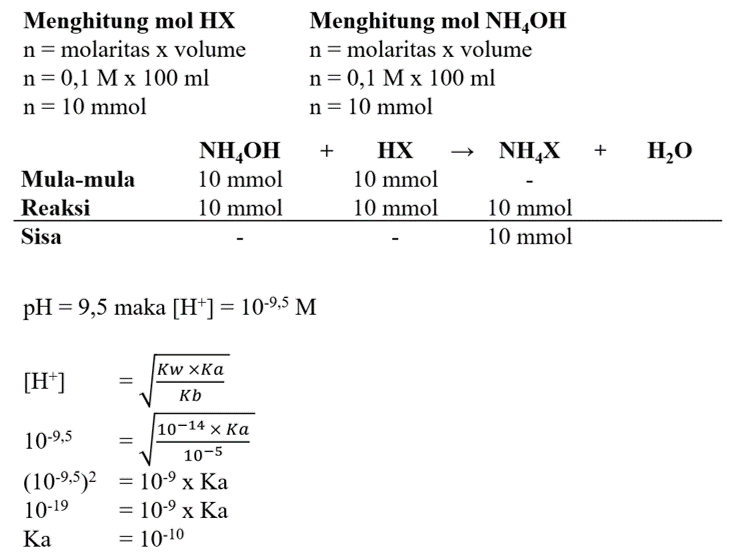
100 mL asam lemah HX 0,1 M direaksikan dengan 100 mL NH4OH 0,1 M menghasilkan larutan dengan pH = 9,5. Bila harga Kb = 10-5, maka harga Ka HX adalah ...
1
1
Iklan
I. Wulandari
Mahasiswa/Alumni Universitas Sebelas Maret
22 Februari 2023 03:39
<p>Jawaban benar adalah 10<sup>-10</sup>.</p><p> </p><p>Garam merupakan senyawa yang dihasilkan dari reaksi asam dan basa. Garam terhidrolisis apabila tidak ada mol sisa reaksi. Garam yang dilarutkan dalam air akan terurai menjadi kation dan anion nya. Hidrolisis adalah reaksi antara kation dan anion dengan air yang menyebabkan air terurai menjadi ion H⁺ atau OH⁻.</p><p> </p><p>Macam-macam hidrolisis yaitu:</p><p>1. Hidrolisis total, berasal dari asam lemah dan basa lemah yang dilarutkan dalam air. Rumus menghitung [H⁺] adalah:</p><p>[H⁺] = √Kw × Ka / Kb</p><p> </p><p>2. Hidrolisis sebagian/parsial, berasal dari asam kuat dan basa lemah atau basa kuat dan asam lemah.</p><p>Rumus menghitung [H⁺] adalah:</p><p>[H⁺] = √Kw / Kb × [G] × valensi garam</p><p>Rumus menghitung [OH⁻] adalah:</p><p>[OH⁻] = √Kw / Ka × [G] × valensi garam</p><p> </p><p>Pada soal tersebut asam lemah direaksikan dengan basa lemah akan terjadi hidrolisis total. Langkah mengerjakan soal ini silakan simak gambar terlampir. </p><p> </p><p>Jadi, jawaban benar adalah 10<sup>-10</sup>.</p>
Jawaban benar adalah 10-10.
Garam merupakan senyawa yang dihasilkan dari reaksi asam dan basa. Garam terhidrolisis apabila tidak ada mol sisa reaksi. Garam yang dilarutkan dalam air akan terurai menjadi kation dan anion nya. Hidrolisis adalah reaksi antara kation dan anion dengan air yang menyebabkan air terurai menjadi ion H⁺ atau OH⁻.
Macam-macam hidrolisis yaitu:
1. Hidrolisis total, berasal dari asam lemah dan basa lemah yang dilarutkan dalam air. Rumus menghitung [H⁺] adalah:
[H⁺] = √Kw × Ka / Kb
2. Hidrolisis sebagian/parsial, berasal dari asam kuat dan basa lemah atau basa kuat dan asam lemah.
Rumus menghitung [H⁺] adalah:
[H⁺] = √Kw / Kb × [G] × valensi garam
Rumus menghitung [OH⁻] adalah:
[OH⁻] = √Kw / Ka × [G] × valensi garam
Pada soal tersebut asam lemah direaksikan dengan basa lemah akan terjadi hidrolisis total. Langkah mengerjakan soal ini silakan simak gambar terlampir.
Jadi, jawaban benar adalah 10-10.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke Forum
Biar Robosquad lain yang jawab soal kamu

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



