NS
Nuzulul S
06 Februari 2020 02:07
Iklan
NS
Nuzulul S
06 Februari 2020 02:07
Pertanyaan
1. Pasangan larutan berikut ini yang menghasilkan larutan penyangga adalah …. a. 100 mL NH4OH 0,2 M + 100 mL HCl 0,1 M b. 100 mL NH4OH 0,2 M + 100 mL HCl 0,3 M c. 100 mL NaOH 0,2 M + 100 mL CH3COOH 0,2 M d. 100 mL NaOH 0,2 M + 100 mL HCN 0,1 M e. 100 mL NaOH 0,2 M + 100 mL HCN 0,2 M
8
2
Iklan
AY
A. Yanti
23 Desember 2021 03:48
Jawaban terverifikasi
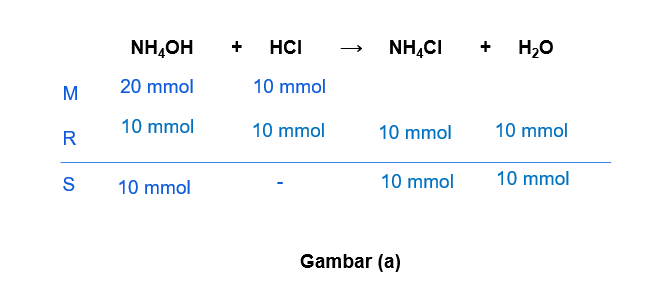
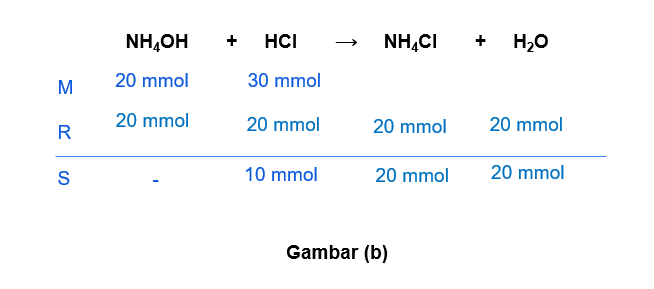
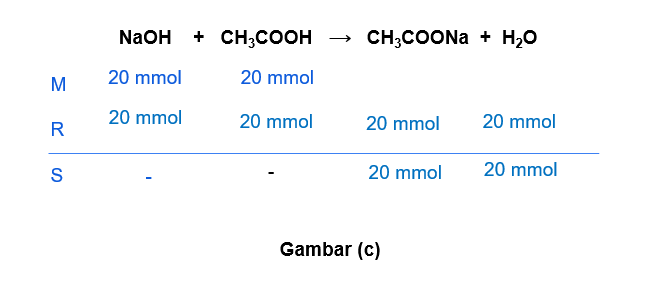
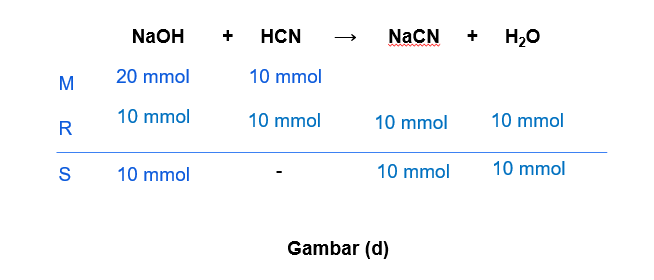
Hallo Nuzulul S, jawaban yang benar adalah A. Untuk lebih jelasnya, yuk simak pembahasan di bawah ini ^_^ Larutan penyangga (buffer) merupakan larutan yang dihasilkan dari reaksi asam/basa kuat dengan asam/basa lemah. Larutan penyangga dapat mempertahankan pH-nya ketika ditambah sedikit asam, basa, atau air. Larutan penyangga terdiri dari 2 jenis, yaitu: - Penyangga asam: larutan yang mengandung asam lemah dan basa konjugasinya (garam). - Penyangga basa: larutan yang mengandung basa lemah dan asam konjugasinya (garam). Untuk menentukan larutan penyangga, dapat kita lihat dari mol yang bersisa ketika kedua larutan direaksikan. Apabila yang bersisa asam/basa lemah maka termasuk larutan penyangga. Apabila yang bersisa asam/basa kuat, maka itu BUKAN larutan penyangga. a. 100 mL NH4OH 0,2 M + 100 mL HCl 0,1 M NH4OH merupakan basa lemah dan HCl merupakan asam kuat. mol NH4OH = M x V = 0,2 M x 100 mL = 20 mmol mol HCl = M x V = 0,1 M x 100 mL = 10 mmol Pada gambar (a) terlihat bahwa dari reaksi tersebut senyawa yang bersisa adalah NH4OH yang merupakan basa lemah. Jadi, opsi a merupakan larutan penyangga. b. 100 mL NH4OH 0,2 M + 100 mL HCl 0,3 M NH4OH merupakan basa lemah dan HCl merupakan asam kuat. mol NH4OH = M x V = 0,2 M x 100 mL = 20 mmol mol HCl = M x V = 0,3 M x 100 mL = 30 mmol Pada gambar (b) terlihat bahwa dari reaksi tersebut senyawa yang bersisa adalah HCl yang merupakan asam kuat. Jadi, opsi b BUKAN merupakan larutan penyangga. c. 100 mL NaOH 0,2 M + 100 mL CH3COOH 0,2 M NaOH merupakan basa kuat dan CH3COOH merupakan asam lemah. mol NaOH = M x V = 0,2 M x 100 mL = 20 mmol mol CH3COOH = M x V = 0,2 M x 100 mL = 20 mmol Pada gambar (c) terlihat bahwa dari reaksi tersebut tidak menghasilkan senyawa bersisa (habis bereaksi). Jadi, opsi c BUKAN merupakan larutan penyangga. d. 100 mL NaOH 0,2 M + 100 mL HCN 0,1 M NaOH merupakan basa kuat dan HCN merupakan asam lemah. mol NaOH = M x V = 0,2 M x 100 mL = 20 mmol mol HCN = M x V = 0,1 M x 100 mL = 10 mmol Pada gambar (d) terlihat bahwa dari reaksi tersebut senyawa yang bersisa adalah NaOH yang merupakan basa kuat. Jadi, opsi d BUKAN merupakan larutan penyangga. e. 100 mL NaOH 0,2 M + 100 mL HCN 0,2 M NaOH merupakan basa kuat dan HCN merupakan asam lemah. mol NaOH = M x V = 0,2 M x 100 mL = 20 mmol mol HCN = M x V = 0,2 M x 100 mL = 20 mmol Pada gambar (e) terlihat bahwa dari reaksi tersebut tidak menghasilkan senyawa bersisa (habis bereaksi). Jadi, opsi e BUKAN merupakan larutan penyangga. Semoga bermanfaat ya ^_^
Lihat 1 lainnya
· 3.8 (14)
Iklan
SW
Sirait W
05 Juni 2023 01:17
Untuk membuat larutan penyangga yang mempunyai pH = 4, ke dalam 100 ml larutan CH3COOH 0,5 M (Ka = 10-5) harus ditambah larutan CH3COONa 0,05 M sebanyak
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



