LT
Livia T
01 Mei 2022 04:59
Iklan
LT
Livia T
01 Mei 2022 04:59
Pertanyaan
Sebanyak 250 ml NH4OH 0,2 M direaksikan dengan 50 ml HCl 1 M, jika Kb NH4OH = 1,8×10^-5 tentukan pH larutan setelah bereaksi !


Belajar bareng Champions
Brain Academy Champions
Hanya di Brain Academy
Habis dalam
01
:
23
:
27
:
39
2
1
Iklan
IY
I. Yassa
01 Mei 2022 08:18
Jawaban terverifikasi
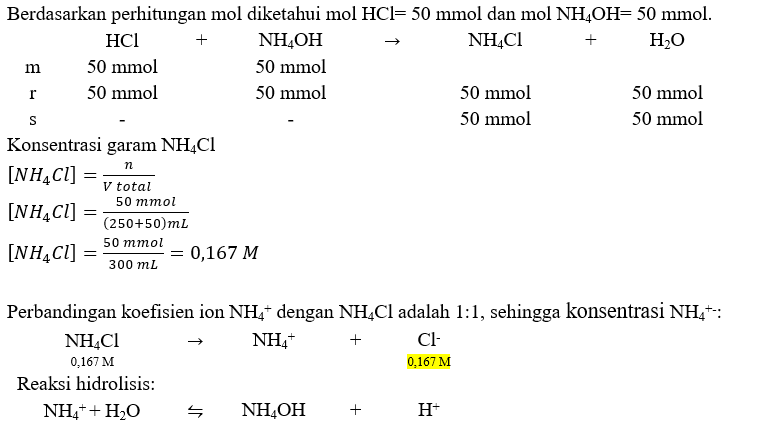
Haloo kak ^^ pH larutan setelah bereaksi adalah 5,5-log 3. Untuk mengetahui pH larutan setelah bereaksi, langkah pertama yang dilakukan adalah menentukan mol ion H⁺ dan OH⁻ pada NH4OH dan HCl. mol ion H⁺ dan OH⁻ dengan rumus: n= M x V dimana: M adalah konsentrasi (molaritas) dengan satuan M, n adalah mol (mol atau mmol), dan V adalah volume (L atau mL). Reaksi ionisasi HCl dan NH4OH adalah: HCl → H⁺ + Cl⁻ (Jumlah ion H⁺ adalah 1) NH4OH ⇌ NH4⁺ + OH⁻ (Jumlah ion OH⁻ adalah 1) mol H⁺ asam kuat HCl n HCl= M x V n HCl= 1 M x 50 mL n HCl= 50 mmol Karena jumlah ion H⁺ adalah 1, maka mol H⁺= mol HCl= 50 mmol. mol OH⁻ basa lemah NH4OH n NH4OH= M x V n NH4OH= 0,2 M x 250 mL n NaOH= 50 mmol Karena jumlah ion OH⁻ adalah 1, maka mol OH⁻= mol NH4OH= 50 mmol. Karena mol ion H⁺ dan OH⁻ sama, maka pada akhir reaksi akan habis bereaksi dan perhitungan pH pada campuran tersebut dihitung dengan rumus hidrolisis garam asam (garam yang terbentuk dari asam kuat dan basa lemah). Perhitungan tersebut ada pada gambar terlampir.

· 0.0 (0)
Iklan
Buka akses jawaban yang telah terverifikasi

Yah, akses pembahasan gratismu habis
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke Forum
Biar Robosquad lain yang jawab soal kamu

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!
Iklan

