Stephanus M
12 Oktober 2023 15:52
Iklan
Stephanus M
12 Oktober 2023 15:52
Pertanyaan
sebanyak 25 ml larutan Al(OH)3 0,1 M direaksikan dengan 25 ml HCl 0,1 M menurut reaksi : Al(OH)3 + HCl ⇔ AlCl3 + H2 jika diketahui Kb Al(OH)3=1×10^(−5), tentukan pH larutan campuran tersebut!
1
1
Iklan
Y. Frando
30 Oktober 2023 22:23
<p>Jawaban yang benar adalah 9,3.</p><p> </p><p>Diketahui:</p><p>25 ml larutan Al(OH)3 0,1 M direaksikan dengan 25 ml HCl 0,1 M</p><p>Reaksi : Al(OH)3 + HCl ⇔ AlCl3 + H2O ----> diralat dari soal asli</p><p>Kb Al(OH)3 = 1×10^(−5)</p><p> </p><p>Ditanya:</p><p>pH larutan campuran = ...?</p><p> </p><p>Jawab:</p><p>Larutan penyangga (buffer) merupakan larutan yang dapat mempertahankan pH jika ditambahkan sedikit asam atau basa kuat dan pengenceran.</p><p>Perhitungan larutan penyangga basa adalah:</p><p>[OH-] = Kb x (nb/ng).</p><p> </p><p>Hubungan pOH dengan pH dirumuskan oleh:</p><p>pH + pOH = 14. </p><p> </p><p>Keterangan:</p><p>[OH-] = konsentrasi ion OH-</p><p>Kb = tetapan ionisasi basa</p><p>nb = mol sisa basa lemah</p><p>ng = mol garam terbentuk.</p><p> </p><p>Berdasarkan informasi soal, tabel perhitungan mula-mula, bereaksi, dan sisa ditunjukkan pada foto di bawah. Terlihat bahwa basa lemah bersisa, sehingga [OH<sup>-</sup>] larutannya adalah:</p><p>[OH<sup>-</sup>] = Kb x (nb/ng)</p><p>[OH<sup>-</sup>] = 1×10^(−5) x (1,67 mmol/0,83 mmol)</p><p>[OH<sup>-</sup>] = 1×10^(−5) x 2,01</p><p>[OH<sup>-</sup>] = 2,01 × 10^(−5) M.</p><p> </p><p>Sehingga nilai pOH adalah:</p><p>pOH = -log [OH<sup>-</sup>]</p><p>pOH = -log (2,01 x 10^(−5))</p><p>pOH = 5 - log (2,01)</p><p>pOH = 5 - 0,303</p><p>pOH = 4,697.</p><p> </p><p>Dan nilai pH nya adalah:</p><p>pH + pOH = 14</p><p>pH = 14 - 4,697</p><p>pH = 9,303</p><p>pH ≈ 9,3.</p><p> </p><p>Jadi, pH larutan campuran tersebut adalah 9,3.</p>
Jawaban yang benar adalah 9,3.
Diketahui:
25 ml larutan Al(OH)3 0,1 M direaksikan dengan 25 ml HCl 0,1 M
Reaksi : Al(OH)3 + HCl ⇔ AlCl3 + H2O ----> diralat dari soal asli
Kb Al(OH)3 = 1×10^(−5)
Ditanya:
pH larutan campuran = ...?
Jawab:
Larutan penyangga (buffer) merupakan larutan yang dapat mempertahankan pH jika ditambahkan sedikit asam atau basa kuat dan pengenceran.
Perhitungan larutan penyangga basa adalah:
[OH-] = Kb x (nb/ng).
Hubungan pOH dengan pH dirumuskan oleh:
pH + pOH = 14.
Keterangan:
[OH-] = konsentrasi ion OH-
Kb = tetapan ionisasi basa
nb = mol sisa basa lemah
ng = mol garam terbentuk.
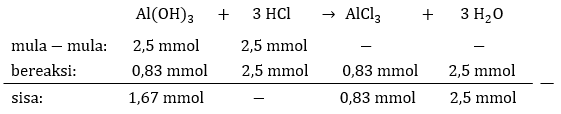
Berdasarkan informasi soal, tabel perhitungan mula-mula, bereaksi, dan sisa ditunjukkan pada foto di bawah. Terlihat bahwa basa lemah bersisa, sehingga [OH-] larutannya adalah:
[OH-] = Kb x (nb/ng)
[OH-] = 1×10^(−5) x (1,67 mmol/0,83 mmol)
[OH-] = 1×10^(−5) x 2,01
[OH-] = 2,01 × 10^(−5) M.
Sehingga nilai pOH adalah:
pOH = -log [OH-]
pOH = -log (2,01 x 10^(−5))
pOH = 5 - log (2,01)
pOH = 5 - 0,303
pOH = 4,697.
Dan nilai pH nya adalah:
pH + pOH = 14
pH = 14 - 4,697
pH = 9,303
pH ≈ 9,3.
Jadi, pH larutan campuran tersebut adalah 9,3.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke Forum
Biar Robosquad lain yang jawab soal kamu

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



