Via N
12 Oktober 2023 05:17
Iklan
Via N
12 Oktober 2023 05:17
Pertanyaan
Pada kalorimeter sederhana dimasukkan 100 mL 1 M NaOH yang selanjutnya direaksikan dengan 100 mL 1 M HCl. Temperatur larutan (d = 1 g/mL) dalam kalorimeter meningkat dari 25°C menjadi 32,1°C. Jika kalor jenis larutan adalah 4,2 J/g°C, perubahan entalpi reaksi netralisasi tersebut adalah ... A. −60 kJ/mol B. −6 kJ/mol C. +6 kJ/mol D. +60 kJ/mol E. +30 kJ/mol
4
1
Iklan
D. Lestari,
Mahasiswa/Alumni Universitas Islam Negeri Maulana Malik Ibrahim Malang
01 Desember 2023 00:22
<p>Jawaban yang benar adalah A. -60 kJ/mol </p><p>Pembahasan </p><p>Kalorimeter adalah alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan reaksi kimia. </p><p>Kalor adalah energi panas yang berpindah dari sistem ke lingkungan atau sebaliknya. </p><p>Besarnya kalor dapat dihitung dengan rumus </p><p>q = m x c x ∆T </p><p>dengan </p><p>q = kalor reaksi (Joule atau kiloJoule) </p><p>m = massa zat (gr) </p><p>c = kalor jenis larutan (J/g°C) </p><p>∆T = perubahan suhu (°C) </p><p> = T2 - T1 </p><p>Perubahan entalpi adalah jumlah kalor yang dibebaskan atau diserap oleh sistem saat reaksi berlangsung. </p><p>Perubahan entalpi (∆H) dapat dicari dengan rumus </p><p>∆H = -q/mol </p><p> </p><p>Diketahui: volume NaOH 1 M = 100 mL </p><p>volume HCl 1 M = 100 mL </p><p>densitas larutan (d) = 1 g/mL </p><p>T1 = 25°C </p><p>T2 = 32,1°C </p><p>c = 4,2 J/g°C </p><p>Ditanya: perubahan entalpi (∆H)? </p><p>Jawab: tahapan pengerjaan </p><p>1. Mencari mol reaksi </p><p>Mol reaksi yaitu hasil reaksi campuran NaOH dengan HCl melalui reaksi MRS </p><p>Mencari mol NaOH dan mol HCl </p><p>mol NaOH = M x V </p><p> = 1 M x 0,1 L </p><p> = 0,1 mol </p><p>mol HCl = M x V </p><p> = 1 M x 0,1 L </p><p> = 0,1 mol </p><p>reaksi MRS dapat dilihat pada lampiran </p><p>Dari reaksi MRS didapatkan mol hasil reaksi yaitu NaCl 0,1 mol 2. Mencari kalor reaksi </p><p>V total = V NaOH + V HCl </p><p> = 100 mL + 100 mL</p><p> = 200 mL </p><p>massa = d x V </p><p> = 1 g/mL x 200 mL </p><p> = 200 g </p><p>q = m x c x ∆T </p><p> = 200 x 4,2 x (32,1°C - 25°C) </p><p> = 200 x 4,2 x 7,1°C </p><p> = 5.964 Joule </p><p>3. Mencari perubahan entalpi (∆H) </p><p>∆H = -q/mol </p><p> = -5.964/0,1 </p><p> = -59.640 Joule </p><p> = -59,64 kiloJoule </p><p> = -60 kiloJoule </p><p> </p><p>Maka perubahan entalpi reaksi netralisasi tersebut adalah -60 kiloJoule</p>
Jawaban yang benar adalah A. -60 kJ/mol
Pembahasan
Kalorimeter adalah alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan reaksi kimia.
Kalor adalah energi panas yang berpindah dari sistem ke lingkungan atau sebaliknya.
Besarnya kalor dapat dihitung dengan rumus
q = m x c x ∆T
dengan
q = kalor reaksi (Joule atau kiloJoule)
m = massa zat (gr)
c = kalor jenis larutan (J/g°C)
∆T = perubahan suhu (°C)
= T2 - T1
Perubahan entalpi adalah jumlah kalor yang dibebaskan atau diserap oleh sistem saat reaksi berlangsung.
Perubahan entalpi (∆H) dapat dicari dengan rumus
∆H = -q/mol
Diketahui: volume NaOH 1 M = 100 mL
volume HCl 1 M = 100 mL
densitas larutan (d) = 1 g/mL
T1 = 25°C
T2 = 32,1°C
c = 4,2 J/g°C
Ditanya: perubahan entalpi (∆H)?
Jawab: tahapan pengerjaan
1. Mencari mol reaksi
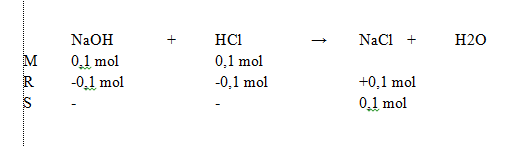
Mol reaksi yaitu hasil reaksi campuran NaOH dengan HCl melalui reaksi MRS
Mencari mol NaOH dan mol HCl
mol NaOH = M x V
= 1 M x 0,1 L
= 0,1 mol
mol HCl = M x V
= 1 M x 0,1 L
= 0,1 mol
reaksi MRS dapat dilihat pada lampiran
Dari reaksi MRS didapatkan mol hasil reaksi yaitu NaCl 0,1 mol 2. Mencari kalor reaksi
V total = V NaOH + V HCl
= 100 mL + 100 mL
= 200 mL
massa = d x V
= 1 g/mL x 200 mL
= 200 g
q = m x c x ∆T
= 200 x 4,2 x (32,1°C - 25°C)
= 200 x 4,2 x 7,1°C
= 5.964 Joule
3. Mencari perubahan entalpi (∆H)
∆H = -q/mol
= -5.964/0,1
= -59.640 Joule
= -59,64 kiloJoule
= -60 kiloJoule
Maka perubahan entalpi reaksi netralisasi tersebut adalah -60 kiloJoule
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke Forum
Biar Robosquad lain yang jawab soal kamu

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



