EE
Egie E
09 April 2023 15:11
Iklan
EE
Egie E
09 April 2023 15:11
Pertanyaan
mencari pH
mencari pH

1
1
Iklan
JS
J. Siregar
Mahasiswa/Alumni Universitas Negeri Medan
10 April 2023 02:19
Jawaban terverifikasi
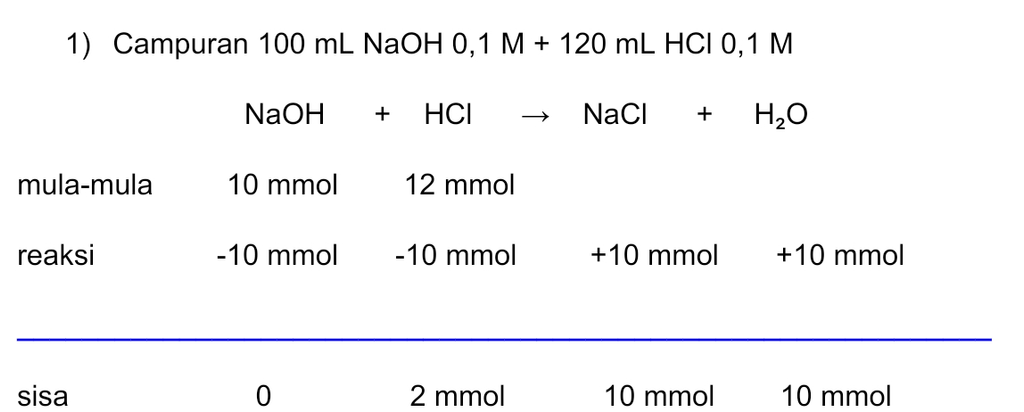
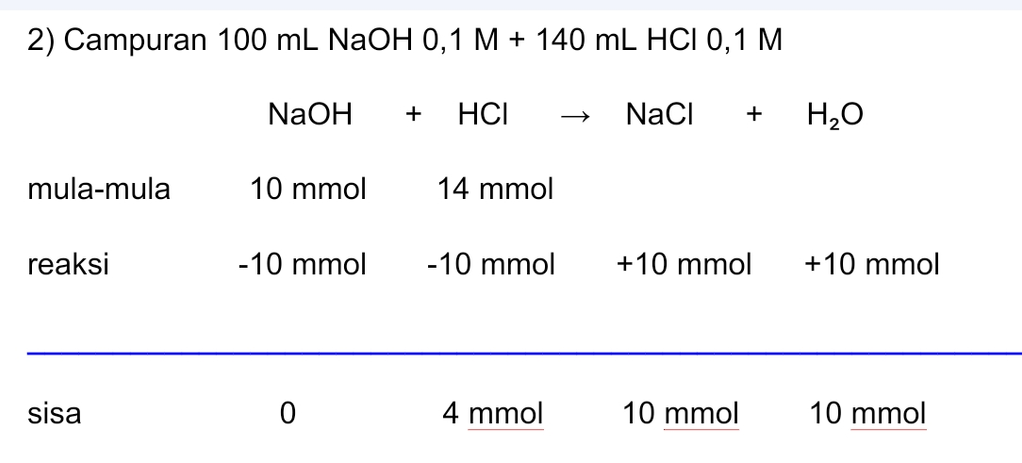
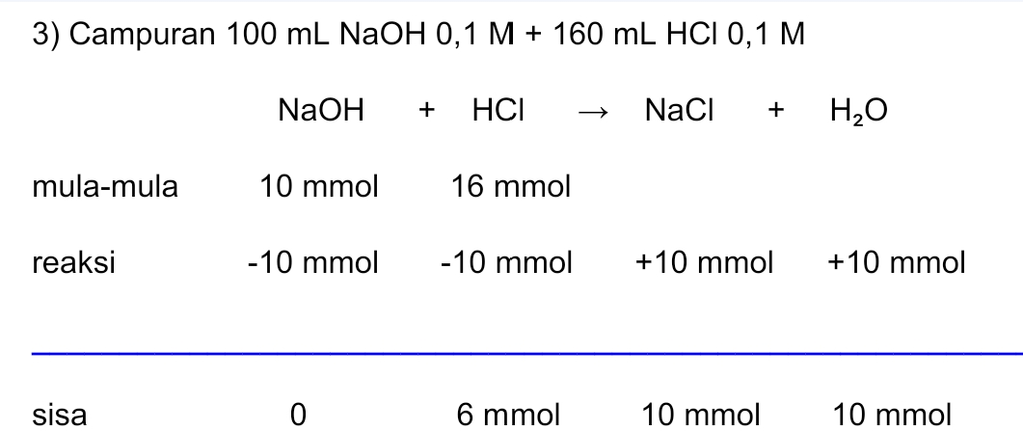
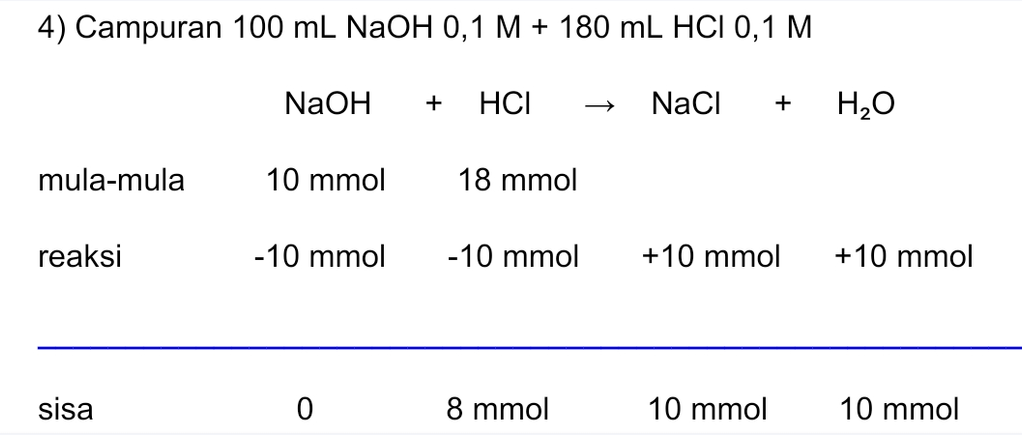
Jawaban yang benar adalah: 1) pH = 3 - log 9 2) pH = 2 - log 1,67 3) pH = 2 - log 2,3 4) pH = 2 - log 2,9 Campuran asam kuat dan basa kuat akan memiliki tiga kemungkinan berikut. • Asam-basa akan habis bereaksi sehingga terbentuk garam yang bersifat netral. • Basa kuat habis bereaksi dan asam kuat bersisa, sehingga pH campuran ditentukan dari asam kuat. • Asam kuat habis bereaksi dan basa kuat bersisa, sehingga pH campuran ditentukan dari basa kuat. 1) Campuran 100 mL NaOH 0,1 M + 120 mL HCl 0,1 M nNaOH = M.V = 0,1×100 = 10 mmol nHCl = M.V = 0,1×120 = 12 mmol >> Bersisa 2 mmol HCl sehingga pH larutan ditentukan dari pH HCl. HCl merupakan asam kuat yang terionisasi sempurna. HCl ---> H+ + Cl- Valensi asam (a) = 1 [HCl] = n/Volume total = 2 mmol ÷ (100 + 120) mL = 9×10-³ M [H+] = b.M = 1 × 9×10-³ M = 9×10-³ M pH = -log [H+] = -log (9×10-³ M) = 3 - log 9 2) Campuran 100 mL NaOH 0,1 M + 140 mL HCl 0,1 M nNaOH = M.V = 0,1×100 = 10 mmol nHCl = M.V = 0,1×140 = 14 mmol >> Bersisa 4 mmol HCl sehingga pH larutan ditentukan dari pH HCl. HCl merupakan asam kuat yang terionisasi sempurna. HCl ---> H+ + Cl- Valensi asam (a) = 1 [HCl] = n/Volume total = 4 mmol ÷ (100 + 140) mL = 1,67×10-² M [H+] = a.M = 1×1,67×10-² M = 1,67×10-² M pH = -log [H+] = -log (1,67×10-²) = 2 - log 1,67 3) Campuran 100 mL NaOH 0,1 M + 160 mL HCl 0,1 M nNaOH = M.V = 0,1×100 = 10 mmol nHCl = M.V = 0,1×160 = 16 mmol >> Bersisa 6 mmol HCl sehingga pH larutan ditentukan dari pH HCl. HCl merupakan asam kuat yang terionisasi sempurna. HCl ---> H+ + Cl- Valensi asam (a) = 1 [HCl] = n/Volume total = 6 mmol ÷ (100 + 160) mL = 2,3×10-² M [H+] = b.M = 1×2,3×10-² M = 2,3×10-² M pH = -log [H+] = -log (2,3×10-² M) = 2 - log 2,3 4) Campuran 100 mL NaOH 0,1 M + 180 mL HCl 0,1 M nNaOH = M.V = 0,1×100 = 10 mmol nHCl = M.V = 0,1×180 = 18 mmol >> Bersisa 8 mmol HCl sehingga pH larutan ditentukan dari pH HCl. HCl merupakan asam kuat yang terionisasi sempurna. HCl ---> H+ + Cl- Valensi asam (a) = 1 [HCl] = n/Volume total = 8 mmol ÷ (100 + 180) mL = 2,9×10-² M [H+] = b.M = 1×2,9×10-² M = 2,9×10-² M pH = -log [H+] = -log (2,9×10-² M) = 2 - log 2,9
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke Forum
Biar Robosquad lain yang jawab soal kamu

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



