Maria M
15 Januari 2023 05:57
Iklan
Maria M
15 Januari 2023 05:57
Pertanyaan
Jika X adalah unsur golongan VIA, maka berdasarkan sifat periodik unsur, senyawa dengan tipe ikatan kovalen adalah ... a. CX3 b. NaX c. NX2 d. B2X3 e. BeX
1
1
Iklan
J. Siregar
Mahasiswa/Alumni Universitas Negeri Medan
31 Januari 2023 08:21
<p>Jawaban yang benar adalah C.</p><p> </p><p>Struktur Lewis adalah tata cara untuk menuliskan elektron valensi unsur atau kumpulan unsur menggunakan lambang Lewis. Lambang Lewis dinyatakan dengan menuliskan lambang atom dikelilingi oleh sejumlah lambang yang digunakan untuk menggambarkan elektron valensi. Elektron valensi atau elektron pada kulit terluar memperlihatkan kemampuan suatu atom untuk berikatan dengan atom lain. </p><p> </p><p>Untuk menentukan struktur Lewis dari senyawa NX2, perlu ditentukan dahulu konfigurasi elektronnya. </p><p>• X golongan VIA berarti ada 6 elektron valensinya. </p><p>• Nomor atom unsur N = 7, maka konfigurasi elektronnya yaitu: </p><p>• 7N = 2 5 elektron valensi = 5</p><p>• X dengan elektron valensi = 6 </p><p> </p><p>Atom N dan atom X akan menggunakan elektron bersama agar kedua atom mencapai kestabilan. Kedua unsur ini adalah unsur nonlogam. Maka, ikatan yang dapat terbentuk adalah ikatan kovalen, yaitu saling berbagi elektron untuk membentuk ikatan. Senyawa NX2 artinya 1 atom N harus mengikat 2 atom X. </p><p>Struktur Lewis dari NX2 dapat dilihat pada gambar di lampiran. Lambang garis menunjukkan ikatan kovalen yang terbentuk dan 1 garis mewakili sepasang elektron.</p><p> </p><p>Jadi, senyawa dengan tipe ikatan kovalen adalah NX2.</p>
Jawaban yang benar adalah C.
Struktur Lewis adalah tata cara untuk menuliskan elektron valensi unsur atau kumpulan unsur menggunakan lambang Lewis. Lambang Lewis dinyatakan dengan menuliskan lambang atom dikelilingi oleh sejumlah lambang yang digunakan untuk menggambarkan elektron valensi. Elektron valensi atau elektron pada kulit terluar memperlihatkan kemampuan suatu atom untuk berikatan dengan atom lain.
Untuk menentukan struktur Lewis dari senyawa NX2, perlu ditentukan dahulu konfigurasi elektronnya.
• X golongan VIA berarti ada 6 elektron valensinya.
• Nomor atom unsur N = 7, maka konfigurasi elektronnya yaitu:
• 7N = 2 5 elektron valensi = 5
• X dengan elektron valensi = 6
Atom N dan atom X akan menggunakan elektron bersama agar kedua atom mencapai kestabilan. Kedua unsur ini adalah unsur nonlogam. Maka, ikatan yang dapat terbentuk adalah ikatan kovalen, yaitu saling berbagi elektron untuk membentuk ikatan. Senyawa NX2 artinya 1 atom N harus mengikat 2 atom X.
Struktur Lewis dari NX2 dapat dilihat pada gambar di lampiran. Lambang garis menunjukkan ikatan kovalen yang terbentuk dan 1 garis mewakili sepasang elektron.
Jadi, senyawa dengan tipe ikatan kovalen adalah NX2.
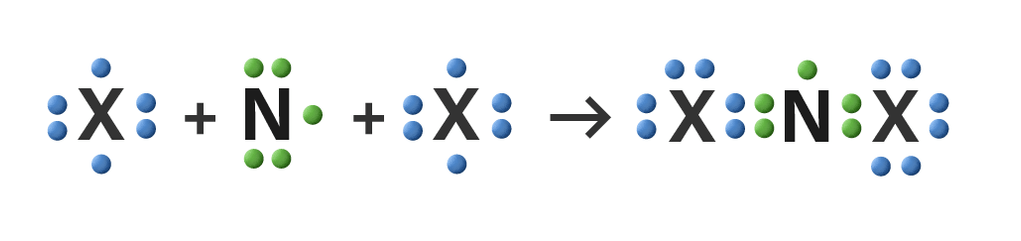
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke Forum
Biar Robosquad lain yang jawab soal kamu

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



