RS
RISKO S
24 Maret 2020 07:28
Iklan
RS
RISKO S
24 Maret 2020 07:28
Pertanyaan
jelaskan pendapat anda terhadap reaksi berikut: AgNo3 + NaCl~AgCl + NaNo3 apakah reaksi teesebut redoks atau bukan? jelaskan jawaban anda!
6
2
Iklan
AY
A. Yanti
24 Desember 2021 14:06
Jawaban terverifikasi
Hallo Risko S, jawaban untuk soal ini yaitu reaksi tersebut BUKAN reaksi redoks karena tidak terdapat perubahan bilangan oksidasi. Untuk lebih jelasnya, yuk simak pembahasan di bawah ini ya ^_^ Reaksi redoks merupakan singkatan dari reduksi dan oksidasi. Reaksi redoks memiliki 3 konsep, yaitu: 1. Berdasarkan pelepasan dan pengikatan oksigen 2. Berdasarkan transfer elektron 3. Berdasarkan perubahan bilangan oksidasi (biloks) Untuk menyelesaikan soal ini, konsep yang digunakan adalah reaksi redoks berdasarkan perubahan bilangan oksidasi. Reaksi reduksi merupakan reaksi yang terjadi karena adanya penurunan biloks , sedangkan reaksi oksidasi terjadi karena adanya peningkatan biloks. Bilangan oksidasi (biloks) ini merupakan muatan positif dan negatif yang terdapat pada suatu atom. Biasanya nilai biloks akan sama dengan muatan yang dimiliki suatu atom. Dari reaksi di atas, kita perlu menentukan terlebih dahulu biloks masing-masing unsurnya yang merujuk pada aturan biloks. Aturan biloks yang akan digunakan yaitu: - jumlah biloks unsur-unsur yang membentuk senyawa netral = 0. - biloks O = -2, kecuali pada senyawa peroksida atau superoksida. - biloks unsur yang termasuk golongan IA = +1. 1) Senyawa AgNO3 Senyawa AgNO3 membentuk senyawa netral. Untuk menentukan biloks masing-masing unsurnya, kita dapat menguraikannya terlebih dahulu. AgNO3 --> Ag+ + NO3- Karena biloks akan sama dengan muatannya, maka biloks Ag = +1, biloks O = -2 karena membentuk senyawa oksida, sedangkan untuk N dapat dihitung dengan persamaan: Muatan NO3- = biloks N + 3(biloks O) -1 = biloks N + 3(-2) -1 = biloks N + (-6) Biloks N = 6 – 1 Biloks N = +5 2)Senyawa NaCl Senyawa NaCl membentuk senyawa netral. Na merupakan unsur yang terletak pada golongan IA, sehingga ia memiliki biloks Na=+1. Adapun untuk biloks Cl: Muatan NaCl = biloks Na + biloks Cl 0 = +1 + biloks Cl Biloks Cl = 0 – 1 Biloks Cl = -1 3)Senyawa AgCl AgCl membentuk senyawa netral. Untuk menentukan biloks masing-masing unsurnya, kita perlu menguraikannya terlebih dahulu. AgCl --> Ag+ + Cl- Karena biloks akan sama dengan muatannya, maka biloks Ag = +1 dan biloks Cl = -1. 4) Senyawa NaNO3 Senyawa NaNO3 membentuk senyawa netral. Biloks Na = +1 (karena unsur Na terletak pada golongan IA). Biloks O = -2 karena membentuk senyawa oksida. Untuk biloks N: Muatan NaNO3 = biloks Na + biloks N + 3(biloks O) 0 = +1 + biloks N + 3(-2) 0 = -5 + biloks N Biloks N = 0 + 5 Biloks N = +5 Setelah mengetahui biloks masing-masing, apabila kita lihat pada gambar ternyata tidak terjadi perubahan biloks dari keempat unsur yang diketahui. Sehingga reaksi tersebut BUKAN reaksi redoks. Semoga bermanfaat ya ^_^
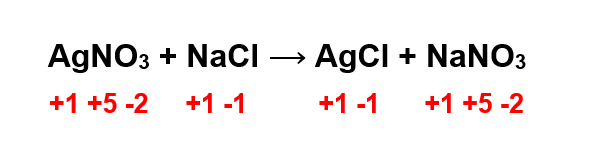
· 5.0 (5)
Iklan
AA
Alfin A
02 Februari 2023 04:25
AgNO3 + NaCl
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



