WW
Widhi W
10 April 2020 03:35
Iklan
WW
Widhi W
10 April 2020 03:35
Pertanyaan
Berapa gram amonium sulfat, (NH4)2SO4, harus ditambahkan ke dalam 50 mL larutan NH3 0,1 M untuk mendapatkan larutan penyangga dengan pH = 9? (Kb NH3 = 1,6 x 10^{-5}; Ar H=1; N=14; O=16; S=32) keterangan : ^{-5} = pangkat -5
2
2
Iklan
DA
D. Aprilia
Mahasiswa/Alumni Universitas Pendidikan Indonesia
28 Desember 2021 15:50
Jawaban terverifikasi
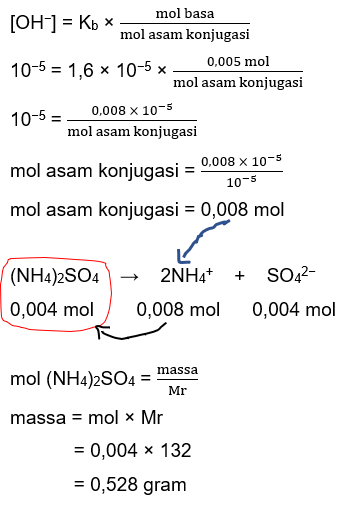
Halo, Widhi :) Jadi, massa amonium sulfat nya yaitu 0,528 gram. Agar lebih paham, yuk simak penjelasan berikut! Campuran NH3 dengan (NH4)2SO4 membentuk sistem penyangga yang bersifat basa. NH3 disini berperan sebagai basa, dan garam (NH4)2SO4 terurai menjadi NH4+ yang merupakan asam konjugasinya. Dari data pH, kita bisa menentukan: pOH = 14 – pH pOH = 14 – 9 pOH = 5 pOH = –log[OH–] 5 = –log[OH–] [OH–] = 10^–5 Mol basa: mol NH3 = M × V dimana M adalah konsentrasi NH3 (Molar) dan V adalah volumenya (L) mol NH3 = 0,1 M × 0,005 L mol NH3 = 0,005 mol Untuk menentukan mol asam konjugasi yang selanjutnya digunakan dalam menghitung massa garam amonium sulfat, perhatikan perhitungan pada gambar berikut:
· 5.0 (1)
Iklan
MA
Mia A
23 April 2020 22:37
Ph=9 POH=5 [OH-]=10^-5 NH3 5mmol [OH-]= Kb. B/AK 10^-5 = 1,6×10-5 . 5/x 10^-5x=1,6x10^-5 x=1,6 x 10^-5/10^-5 ×=1,6 M (NH4)2SO4 M=gr/Mr x 1000/ml 1,6=gr/132 x 1000/50 1,6=20gr/132 20gr= 1,6 ×132 gr=211,2 gram
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



